ņä£ ļĪĀ
ļ¦īņä▒ ļČĆļ╣äļÅÖņŚ╝ņØĆ ļ░öņØ┤ļ¤¼ņŖżņÖĆ ņäĖĻĘĀ Ļ░ÉņŚ╝ņØ┤ ņŻ╝ļÉ£ ņøÉņØĖņØĖ ĻĖēņä▒ ļČĆļ╣äļÅÖņŚ╝Ļ│╝ ļŗ¼ļ”¼ ņĢīļĀłļź┤ĻĖ░, ņĀÉņĢĪņä¼ļ¬©ņłśņåĪ ņØ┤ņāü, ļ®┤ņŚŁņןņĢĀ, ĒĢ┤ļČĆĒĢÖņĀü ņÜöņØĖ ļō▒ ļŗżņ¢æĒĢ£ ņøÉņØĖņØä Ļ░Ćņ¦ĆļŖö ļŗżņØĖņä▒ ņ¦łĒÖśņØ┤ļŗż[1]. ļČäņ×ÉņāØļ¼╝ĒĢÖņØś ļ░£ņĀäņ£╝ļĪ£ 1990ļģäļīĆņŚÉ ļōżņ¢┤ ļ¦īņä▒ ļČĆļ╣äļÅÖņŚ╝ņØś ļ░£ļ│æņŚÉ ņ¦äĻĘĀņØś ņŚŁĒĢĀņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØä Ļ░Ćņ¦ĆĻ▓ī ļÉśņŚłļŗż[2]. ņ¦äĻĘĀļōżņØ┤ ļ╣äĻ░ĢņāüĒö╝ņäĖĒż, ņä¼ņ£ĀņĢäņäĖĒż, ĒśĖņé░ĻĄ¼ ļō▒ņØś ļ®┤ņŚŁņäĖĒżņÖĆ ņāüĒśĖņ×æņÜ®ņØä ļ│┤ņØĖļŗżļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[3,4]. ņ¦äĻĘĀņØ┤ ĒśĖĒØĪĻĖ░ ņĀÉļ¦ēņØś ņäĀņ▓£ņä▒ Ēś╣ņØĆ Ēøäņ▓£ņä▒ ļ®┤ņŚŁļ░śņØæņØä ņ£Āļ░£ĒĢśņŚ¼ ļŗżņ¢æĒĢ£ ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņØś ļ░£ļ│æņŚÉ Ļ┤ĆņŚ¼ĒĢśļ®░, ļ¦īņä▒ ļČĆļ╣äļÅÖņŚ╝ņØś ļ░£ļ│æĻ│╝ ņŚ░Ļ┤ĆĒĢśņŚ¼ņä£ļÅä ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ĒśĖĒØĪĻĖ░ ņĀÉļ¦ē ņ¦äĻĘĀņ┤Ø(mycobiome)ņØś ņŚŁĒĢĀņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ ļśÉĒĢ£ ĒÖ£ļ░£Ē׳ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ņ£╝ļ®░, ņ¦äĻĘĀņ┤ØņØś ļ│ĆĒÖö ļśÉĒĢ£ ĒśĖĒØĪĻĖ░ ņ¦łĒÖśņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ņØīņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[5,6].
ņāØļ¼╝ļ¦ēņØĆ ļ»ĖņāØļ¼╝ņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ä ņäĖĒżņÖĖ Ļ│ĀļČäņ×É ļ¼╝ņ¦ł(extracellular polymeric substances)Ļ│╝ ņäĖĒżņÖĖ ĻĖ░ņ¦ł(extracellular matrix)ņØä ļ░öĒāĢņ£╝ļĪ£ ĒĢśļŖö ļ»ĖņāØļ¼╝ Ļ│ĄļÅÖņ▓┤ļĪ£ ņłÖņŻ╝ņØś ļ░®ņ¢┤ ĻĖ░ņĀäņØä ĒÜīĒö╝ĒĢśĻ│Ā ņĢĮļ¼╝ņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØä Ļ░Ćņ¦ĆĻ▓ī ĒĢśņŚ¼ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ļČłņØæņä▒ Ļ░ÉņŚ╝ņŚÉ Ļ┤ĆņŚ¼ĒĢ£ļŗż. ņāØļ¼╝ļ¦ēņØĆ ņäĖĻĘĀļ┐É ņĢäļŗłļØ╝ ņ¦äĻĘĀņŚÉ ņØśĒĢ┤ņä£ļÅä ĒśĢņä▒ļÉ£ļŗż. ļ¦īņä▒ ļČĆļ╣äļÅÖņŚ╝ņØś Ļ▓ĮņÜ░ 44%-92%ņŚÉņä£ ņäĖĻĘĀņä▒ ņāØļ¼╝ļ¦ēĻ│╝ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØ┤ ĒĢ©Ļ╗ś ņĪ┤ņ×¼ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØĆ ĒśĖņé░ĻĄ¼ņä▒ ņĀÉņĢĪņŚÉņä£ ĒØöĒ׳ ļ░£Ļ▓¼ļÉ£ļŗż[7]. ĒśĖĒØĪņØä ĒåĄĒĢ┤ ĻĖ░ļÅäļĪ£ ļōżņ¢┤ņś© ņ¦äĻĘĀ Ēżņ×ÉļōżņØ┤ ĻĖ░ļÅä ņĀÉļ¦ēņØś ņäĀņ▓£ņä▒ ļ░®ņ¢┤ĻĖ░ņĀäņØä ĒåĄĒĢ┤ ņĀ£Ļ▒░ļÉśņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓ĮņÜ░ ņĀÉļ¦ē ļé┤ņŚÉņä£ ļ░£ņĢäĒĢśņŚ¼ ĻĘĀņé¼ņ▓┤ļź╝ ĒśĢņä▒ĒĢśĻ▓ī ļÉśĻ│Ā ņäĖĒżņÖĖ ĻĖ░ņ¦łĻ│╝ ļŗżļŗ╣ļźśņÖĆņØś ņāüĒśĖņ×æņÜ®ņØä ĒåĄĒĢ┤ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØä ĒśĢņä▒ĒĢśĻ▓ī ļÉ£ļŗż. ņ¦äĻĘĀņØĆ ĒśĖĒØĪ ņĀÉļ¦ēņØś ļ░®ņ¢┤ĻĖ░ņĀäņØ┤ ņĀĢņāüņĀüņ£╝ļĪ£ ņ×æļÅÖĒĢśļŖö Ļ▓ĮņÜ░ ņāØļ¼╝ļ¦ēņØä ĒśĢņä▒ĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļéś ļŗżņ¢æĒĢ£ ņøÉņØĖ, ņ”ē ĒśĖĒØĪĻĖ░ ņĀÉļ¦ēņØś ļ¼╝ļ”¼ņĀü ņåÉņāüņØ┤ļéś ņäĖĻĘĀņä▒ Ēś╣ņØĆ ĒĢŁņøÉņŚÉ ņØśĒĢ£ ņĀÉļ¦ēņØś ņåÉņāüņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØ┤ ĒśĢņä▒ļÉĀ ņłś ņ׳ļŗż. Staphylococcus aureusņÖĆ ņ¦äĻĘĀņØä ĒĢ©Ļ╗ś ļ╣äĻ░Ģ ņĀÉļ¦ēņŚÉ ņ▓śļ”¼ĒĢśļŖö Ļ▓ĮņÜ░ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØ┤ ĒśĢņä▒ļÉĀ ņłś ņ׳ņØīņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[8]. ļīĆĒæ£ņĀü ņ¦äĻĘĀņä▒ ļ¦īņä▒ļČĆļ╣äļÅÖņŚ╝ņØĖ ņ¦äĻĘĀĻĄ¼ņØś Ļ▓ĮņÜ░ ņäĖĻĘĀņä▒ Ļ░ÉņŚ╝ņØä ļÅÖļ░śĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļ®░, ņäĖĻĘĀņä▒ ņāØļ¼╝ļ¦ēĻ│╝ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØ┤ Ļ│ĄņĪ┤ĒĢśļŖö Ļ▓āņØä ĒØöĒ׳ ļ░£Ļ▓¼ĒĢĀ ņłś ņ׳ļŗż[9].
ņ¦Ćņ¦łļŗżļŗ╣ļźś(lipopolysaccharide, LPS)ļŖö ĻĘĖļ×īņØīņä▒ĻĘĀņØś ņÖĖļ¦ēņØä ĒśĢņä▒ĒĢśļŖö ņäĖĻĘĀņä▒ ļé┤ļÅģņåīļĪ£ ĒśĖĒØĪĻĖ░ ņŚ╝ņ”Øņä▒ ņ¦łĒÖś ļ░£ļ│æņŚÉ Ļ┤ĆņŚ¼ĒĢ£ļŗż. ĻĘĖļ×īņØīņä▒ĻĘĀņØĆ ņĢĮļ¼╝ņØ┤ļéś ņłśņłĀņĀü ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ļČłņØæņä▒ ļ¦īņä▒ļČĆļ╣äļÅÖņŚ╝ņØś ņøÉņØĖņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, LPSļ¦īņ£╝ļĪ£ļÅä ļ¦īņä▒ļČĆļ╣äļÅÖņŚ╝ņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż[10]. Aspergillus fumigatusļŖö ĒśĖĒØĪĻĖ░ ņ¦äĻĘĀņä▒ ņ¦łĒÖśĻ│╝ ļČĆļ╣äļÅÖ ņ¦äĻĘĀĻĄ¼ ļō▒ņØś ņŻ╝ļÉ£ ņøÉņØĖņ£╝ļĪ£ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØ┤ ĒśĢņä▒ļÉĀ ņłś ņ׳ļŗż[11]. ļ│Ė ņŚ░ĻĄ¼ļŖö LPSņÖĆ A. fumigatus Ēżņ×ÉņØś ĒĢ®ļÅÖļ░░ņ¢æņØ┤ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŖöņ¦Ć ĒÖĢņØĖĒĢ┤ ļ│┤Ļ│Āņ×É ņ¦äĒ¢ēĒĢśņśĆļŗż.
ņ×¼ļŻī ļ░Å ļ░®ļ▓Ģ
A. fumigatus Ēżņ×É ņłśņ¦æ
A. fumigatusļŖö American Type Culture Collection (Rockville, MD, USA)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņśĆļŗż. Potato dextrose corn meal agar ļ░░ņ¦ĆņŚÉņä£ ļ░░ņ¢æ Ēøä ņ¦äĻĘĀ Ēżņ×Éļź╝ ļŗżņØīĻ│╝ Ļ░ÖņØ┤ ļČäļ”¼ĒĢśņśĆļŗż. ļ░░ņ¢æļÉ£ ņ¦äĻĘĀņØä 0.05% tween 20ņØä ņ▓©Ļ░ĆĒĢ£ 5 mLņØś ņØĖņé░ņÖäņČ®ņŗØņŚ╝ņłś(phosphate buffer solution, PBS)ļĪ£ ņäĖņ▓ÖĒĢśņśĆņ£╝ļ®░, ņ¢╗ņ¢┤ņ¦ä ņäĖņ▓ÖņĢĪņØä 1000 rpmņ£╝ļĪ£ 5ļČäĻ░ä ņøÉņŗ¼ļČäļ”¼ Ēøä 40 ╬╝mņØś ņŚ¼Ļ│╝ĻĖ░ņŚÉ ĒåĄĻ│╝ņŗ£ņ╝£ Ēżņ×Éļź╝ ĒÜŹļōØĒĢśņśĆļŗż. 2├Ś107/mLņØś Ēżņ×Éļź╝ 45┬░CņŚÉņä£ Ļ▒┤ņĪ░ņŗ£Ēé© Ēøä -80┬░CņŚÉņä£ ļ│┤Ļ┤ĆĒĢśņśĆļŗż.
ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņØś ļČäļ”¼ ļ░░ņ¢æĻ│╝ A. fumigatus ņ▓śļ”¼
ļ╣äĻ░ĢņāüĒö╝ņäĖĒżļŖö ļ╣äņżæĻ▓® ļ¦īĻ│Īņ”Ø ĒÖśņ×ÉņØś ĒĢśļ╣äĻ░æĻ░£ņŚÉņä£ ļČäļ”¼ĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆļŗż(n=10, ļé©ņ×É 6ļ¬ģ, ņŚ¼ņ×É 4ļ¬ģ, ĒÅēĻĘĀ ļéśņØ┤ 46.2┬▒19.2). ļīĆņāüņ×ÉņØś ņäĀĒāØņØĆ ņĢīļĀłļź┤ĻĖ░ļ╣äņŚ╝ņØ┤ ļÅÖļ░śļÉśņ¦Ć ņĢŖĻ│Ā, ņłśņłĀ ņĀä 4ņŻ╝ ņØ┤ņāü ĒĢŁņāØņĀ£, ĒĢŁĒ׳ņŖżĒāĆļ»╝ņĀ£, ĻĄŁņåī ļ░Å Ļ▓ĮĻĄ¼ņÜ® ņŖżĒģīļĪ£ņØ┤ļō£ņĀ£ņ×¼ ļō▒ņØś ņĢĮļ¼╝ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņØĆ ņśłļĪ£ ĒĢśņśĆņ£╝ļ®░, ļīĆņāüņ×ÉļōżņØĆ ņĀĆņ×É ņåīņåŹ ļ│æņøÉņØś ņ×äņāüņ£żļ”¼ņ£äņøÉĒÜī ņŖ╣ņØĖĒĢśņŚÉ ņ¦äĒ¢ēļÉśņŚłļŗż(CR-20-200-L). ļ╣äņĀÉļ¦ēņØĆ penicillin 100 UI/mL, streptomycin (SM) 100 ╬╝g/mL, amphotericin-B 2 ╬╝g/mLņØä ĒżĒĢ©ĒĢ£ HamŌĆÖs F-12 ļ░░ņ¢æņĢĪ(GIBCO, Grand Island, NY, USA)ņ£╝ļĪ£ ņäĖņ▓Ö Ēøä dispase (GIBCO)ļĪ£ ņ▓śļ”¼ĒĢśņśĆņ£╝ļ®░, 37┬░CņŚÉņä£ trypsin/ethylenediamine tetraacetic acidļĪ£ 10ļČäĻ░ä ļ░░ņ¢æĒĢśņŚ¼ ņāüĒö╝ņäĖĒżļź╝ ļ░Ģļ”¼ĒĢśņśĆļŗż. ļ░Ģļ”¼ļÉ£ ņäĖĒżļōżņØĆ 10 cm ņĀæņŗ£ņŚÉ 1ņŗ£Ļ░ä ļæÉņ¢┤ ņä¼ņ£Āļ¬©ņäĖĒż, ĻĘ╝ņ£ĪņäĖĒż, ĒśłĻ┤Ć ļé┤Ēö╝ņäĖĒżļź╝ ņĀ£Ļ▒░ĒĢśņśĆņ£╝ļ®░, ņØ┤ļĀćĻ▓ī ņ¢╗ņ¢┤ņ¦ä ņāüĒö╝ņäĖĒżļŖö Pc, SM, Amp-B, glutamine 150 ╬╝g/mL, transferrin 5 ╬╝g/mL, insulin 5 UI/mL, epithelial growth factor 25 ng/mL, endothelial cell growth supplement 15 ╬╝g/mL, triiodothyronin 200 pM, hydrocortisone 100 nM, fetal calf serum 15%ņØä ĒżĒĢ©ĒĢ£ HamŌĆÖs F-12ņŚÉ ļäŻĻ│Ā, 37┬░C, 5% CO2ņŚÉņä£ ļ░░ņ¢æĒĢśņśĆļŗż.
A. fumigatusņÖĆ LPSņŚÉ ņØśĒĢ£ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņØś ņāØņĪ┤ļŖźļĀź ļ│ĆĒÖö ņĖĪņĀĢ
A. fumigatusņÖĆ LPSĻ░Ć ļ╣äĻ░ĢņāüĒö╝ņäĖĒż ļČäĒÖöņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ CellTiter-96Ōōć aqueous cell proliferation assay kit (Promega, Madison, WI, USA)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļŗżņ¢æĒĢ£ ļåŹļÅäņØś A. fumigatus (1├Ś102-1├Ś104/mL)ņÖĆ LPS (1-100 ╬╝g/mL)ļĪ£ 37┬░C, 5% CO2 ņāüĒā£ņŚÉņä£ 72ņŗ£Ļ░ä ņ▓śļ”¼ĒĢśņśĆļŗż. ņØ┤Ēøä ĒģīĒŖĖļØ╝ņĪĖļź© ĒÖöĒĢ®ļ¼╝Ļ│╝ ņśżņø¼ ņŗ£ņĢĮņØä ņ▓©Ļ░ĆĒĢśņŚ¼ ņäĖĒż ņé░ĒÖö ĒÖśņøÉĒÜ©ņåī ņ×æņÜ®ņ£╝ļĪ£ ņäĖĒż ļé┤ ļ»ĖĒŖĖņĮśļō£ļ”¼ņĢäņŚÉ ņØśĒĢ┤ ļČłņÜ®ņä▒ Ēżļź┤ļ¦łņ×öņ£╝ļĪ£ ĒÖśņøÉņŗ£Ēé©ļŗż. Ēżļź┤ļ¦łņ×öņØĆ ņāØņĪ┤ ņäĖĒżņØś ņłśļź╝ ļ░śņśüĒĢ┤ ņżĆļŗż. ņØ┤Ēøä 490 nm ĒīīņןņØś ĒśĢĻ┤æ ĒīÉļÅģĻĖ░ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ĒØĪĻ┤æļÅäļź╝ ĒÅēĻ░ĆĒĢ£ļŗż.
ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ĆļŖö interleukin (IL)-6, IL-8ņÖĆ transforming growth factor (TGF)-╬▓1 ņĖĪņĀĢ
A. fumigatus ņ▓śļ”¼ Ēøä 24, 48, 72ņŗ£Ļ░äņŚÉ ņäĖĒżļ░░ņ¢æ ņāüļō▒ņĢĪņØä ĒÜŹļōØĒĢśņŚ¼ -70┬░CņŚÉ ļ│┤Ļ┤ĆĒĢśņśĆļŗż. IL-6, IL-8, TGF-╬▓1ņØś ļåŹļÅäļŖö ĒÜ©ņåī Ļ▓░ĒĢ® ļ®┤ņŚŁ Ēśæņ░® ļČäņäØ ĒéżĒŖĖļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż(R&D system, Minneapolis, MN, USA). IL-6ņÖĆ IL-8ņØś ņĖĪņĀĢ ļ»╝Ļ░ÉļÅäļŖö 2 pg/mLņśĆĻ│Ā TGF-╬▓1ņØĆ 15 pg/mLņśĆļŗż.
A. fumigatus ņāØļ¼╝ļ¦ē ĒÖĢņØĖ
ļ╣äĻ░ĢņāüĒö╝ņäĖĒżĻ░Ć 80%-90%ņØś confluenceĻ░Ć ĒśĢņä▒ļÉśļ®┤ A. fumigatus (1├Ś102/mL)ļĪ£ 2ņŗ£Ļ░ä ņ▓śļ”¼ Ēøä 10 ug/mLņØś LPSļĪ£ 5ņØ╝Ļ░ä ļ░░ņ¢æĒĢśņśĆļŗż. ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æļÉ£ A. fumigatus ņāØļ¼╝ļ¦ēņØś ņĪ┤ņ×¼ņÖĆ LPSņØś ņśüĒ¢źņØĆ ļŗżņØīņØś ļ░®ļ▓Ģņ£╝ļĪ£ ĒÖĢņØĖĒĢśņśĆļŗż. 1) Ļ▒┤ņĪ░ĒĢ£ ņāØļ¼╝ļ¦ēņØś ļ¼┤Ļ▓īļŖö ļ░░ņ¢æ ņĀæņŗ£ņØś ņ¦äĻĘĀņØä ĻĖüņ¢┤ ņ▒äņĘ©ĒĢ£ Ēøä 0.45 ╬╝m Ēü¼ĻĖ░ņØś ņģĆļŻ░ļĪ£ņŖż ņ¦łņé░ņŚ╝ ĒĢäĒä░(Sartorius, Go┬©ttingen, Germany)ļĪ£ ņŚ¼Ļ│╝ Ēøä 40┬░CņŚÉņä£ Ļ▒┤ņĪ░ Ēøä ļ¼┤Ļ▓īļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. 2) Mowat ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ņ¦äĻĘĀ ņāØļ¼╝ļ¦ēņØś ņĀĢļ¤ēņĀü ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż[12]. A. fumigatus ļ░░ņ¢æ ņĀæņŗ£ņŚÉ 0.5% crystalviolet ņĢĪņØä ļäŻĻ│Ā 5ļČä ņ▓śļ”¼ Ēøä PBSļĪ£ ņäĖņ▓ÖĒĢśņśĆņ£╝ļ®░, 100 ╬╝LņØś 95% ņŚÉĒāäņś¼ņØä ļäŻĻ│Ā 1ļČäĻ░ä ņ▓śļ”¼ĒĢśņśĆļŗż. ņāØļ¼╝ļ¦ēņØś ņĀĢļ¤ē ļČäņäØņØä ņ£äĒĢ┤ 570 nm ĒīīņןņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļČäĻ┤æ Ļ┤æļÅäĻ│ä(FLUOstar OPTIMA; BMG LABTECH, Oldenburg, Germany)ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. 3) ņ¦äĻĘĀ ņāØļ¼╝ļ¦ēņØś ņäĖĒżņÖĖ ĻĖ░ņ¦łņØś ĒÖĢņØĖņØä ņ£äĒĢ┤ A. fumigatus ļ░░ņ¢æ ņĀæņŗ£ņŚÉ 50 ╬╝LņØś safranin ņÜ®ņĢĪņØä ļäŻĻ│Ā 72ņŗ£Ļ░ä ļÅÖņĢł ņ▓śļ”¼ĒĢśņŚ¼ ņ¦äĻĘĀ ņāØļ¼╝ļ¦ēņØä ĒśĢņä▒ĒĢśļŖö ļŗżļŗ╣ļźśļź╝ Ļ┤æĒĢÖ ļ░ĆļÅä 492 nmņØś ļČäĻ┤æ Ļ┤æļÅäĻ│äļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. 4) ņ¦äĻĘĀ ņāØļ¼╝ļ¦ēņØä ĒśĢņä▒ĒĢśļŖö ņäĖĒżņÖĖ ĻĖ░ņ¦łņØś ņĀĢļ¤ēņĀü ļČäņäØņØĆ 100 ╬╝LņØś succinylated concanavalin AņÖĆ Alexa Fluor 488 (Invitrogen, Carlsbad, CA, USA)ļĪ£ 37┬░CņŚÉņä£ 45ļČäĻ░ä ņ▓śļ”¼ Ēøä 485 nmņØś ņŚ¼ĻĖ░ ĒīīņןĻ│╝ 520 nmņØś ļ░®ņČ£ ĒīīņןņŚÉņä£ ĒśĢĻ┤æ Ļ░ĢļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. 5) ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatusņØś ĒĢ®ļÅÖ ļ░░ņ¢æ Ēøä ņāØļ¼╝ļ¦ēņØä ņŻ╝ņé¼ĒśĢĻ│Ąņ┤łņĀÉ ļĀłņØ┤ņĀĆ Ēśäļ»ĖĻ▓Į(confocal scanning laser microscopy)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖĢņØĖĒĢśņśĆļŗż. 100 ╬╝MņØś FUN-1 (Invitrogen)Ļ│╝ 100 ╬╝g/mLņØś concanavalin Aļź╝ ļäŻĻ│Ā ņĢöņŗżņŚÉņä£ 45ļČäĻ░ä ņ▓śļ”¼ĒĢśņśĆļŗż. PBSļĪ£ ņäĖņ▓Ö Ēøä NikonA1 Ļ│Ąņ┤łņĀÉ Ēśäļ»ĖĻ▓Į(Kikon, Tokyo, Japan)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņśüņāüņØä ļČäņäØĒĢśņśĆļŗż. ļČēņØĆ ņāēņØĆ ļīĆņé¼Ļ░Ć ĒÖ£ļ░£Ē׳ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŖö ņäĖĒżņØ┤ļ®░, ļģ╣ņāēņØĆ ņäĖĒżļ▓ĮņØä ĒśĢņä▒ĒĢśļŖö ļŗżļŗ╣ļźś, ļģĖļ×ĆņāēņØĆ ļæÉ Ļ░Ćņ¦Ć ņĪ░Ļ▒┤ņØä ļÅÖņŗ£ņŚÉ ņČ®ņĪ▒ĒĢśļŖö Ļ▓ĮņÜ░ ļéśĒāĆļéśļŖö ĒśĢĻ┤æņāēņØ┤ļŗż.
ĒåĄĻ│ä ļČäņäØ
Ļ░üĻ░üņØś ņŗżĒŚśņØĆ 5ĒÜī ņØ┤ņāü ļ░śļ│ĄĒĢśņŚ¼ ĻĘĖ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņ¢┤ ĒÅēĻĘĀ┬▒Ēæ£ņżĆņśżņ░©ļĪ£ Ēæ£ĒśäĒĢśņśĆņ£╝ļ®░, ļæÉ ĻĄ░Ļ░äņØś ļ╣äĻĄÉ ļČäņäØņØĆ Student t-testļź╝ ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ļæÉ ĻĄ░ ņØ┤ņāüņØś ļ╣äĻĄÉļŖö one-way analysisļź╝ ņŗ£Ē¢ē Ēøä TukeyŌĆÖs testļĪ£ ņé¼Ēøä Ļ▓ĆņĀĢĒĢśņśĆļŗż(SPSS ver. 25.0; IBM Corp., Armonk, NY, USA). ĒåĄĻ│äĒĢÖņĀü ņ£ĀņØśņłśņżĆņØĆ p’╝£0.05ļĪ£ ĒĢśņśĆļŗż.
Ļ▓░ Ļ│╝
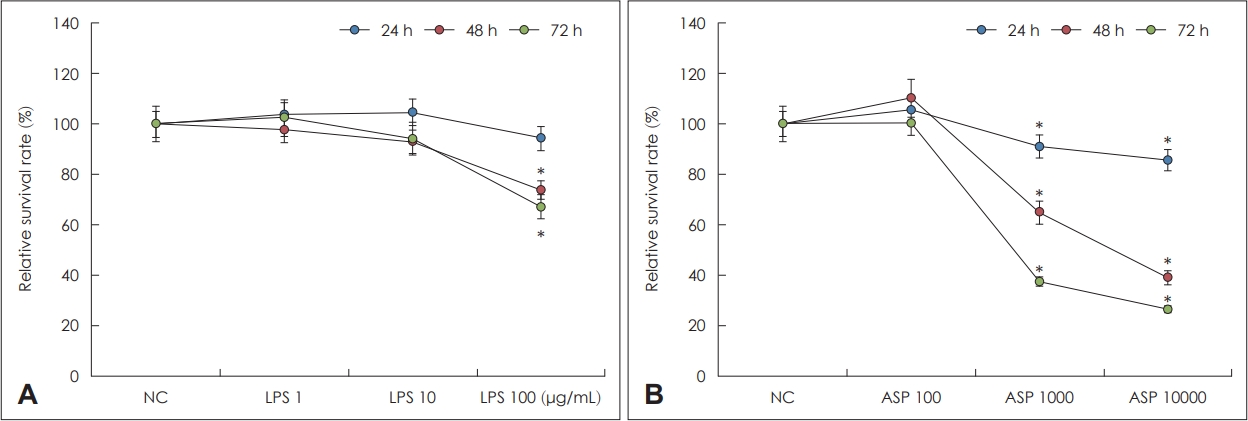
A. fumigatusņÖĆ LPSņØś ļ╣äĻ░ĢņāüĒö╝ņäĖĒż ņāØņĪ┤ ļŖźļĀźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź
ļ╣äĻ░ĢņāüĒö╝ņäĖĒżļź╝ LPS 1 ╬╝g/mL, 10 ╬╝g/mL, 100 ╬╝g/mLļĪ£ 72ņŗ£Ļ░ä ļÅÖņĢł ņ▓śļ”¼ĒĢśņŚ¼ ņäĖĒż ņāØņĪ┤ņØä ĒÖĢņØĖĒĢśņśĆļŗż. LPS 1 ╬╝g/mLĻ│╝ 10 ╬╝g/mLņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 72ņŗ£Ļ░äĻ╣īņ¦Ć ņāüĒö╝ņäĖĒżņØś ļ│ĆĒÖöĻ░Ć ņŚåņŚłņ£╝ļéś, LPS 100 ╬╝g/mLņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 24ņŗ£Ļ░ä ņØ┤ĒøäļČĆĒä░ ņäĖĒż ņāØņĪ┤ ļŖźļĀźņØ┤ ņØśļ»Ėņ׳Ļ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(Fig. 1A). ņØ┤Ēøä ņŚ░ĻĄ¼ņŚÉņä£ļŖö LPS 10 ╬╝g/mLņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż.
A. fumigatusļŖö 1├Ś102/mL, 1├Ś103/mL, 1├Ś104/mL Ēżņ×Éļź╝ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ 1├Ś102/mLņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 72ņŗ£Ļ░äĻ╣īņ¦Ć ņāüĒö╝ņäĖĒżņØś ņāØņĪ┤ ļŖźļĀźņŚÉ ļ│ĆĒÖöĻ░Ć ņŚåņŚłņ£╝ļéś, 1├Ś103/mL, 1├Ś104/mLņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 24ņŗ£Ļ░äļČĆĒä░ ņāØņĪ┤ ļŖźļĀźņØ┤ ņØś ļ»Ėņ׳Ļ▓ī Ļ░ÉņåīļÉ©ņØ┤ ĒÖĢņØĖļÉśņ¢┤, ņØ┤Ēøä ņŚ░ĻĄ¼ņŚÉņä£ļŖö A. fumigatus 1├Ś102/mLļĪ£ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż(Fig. 1B).
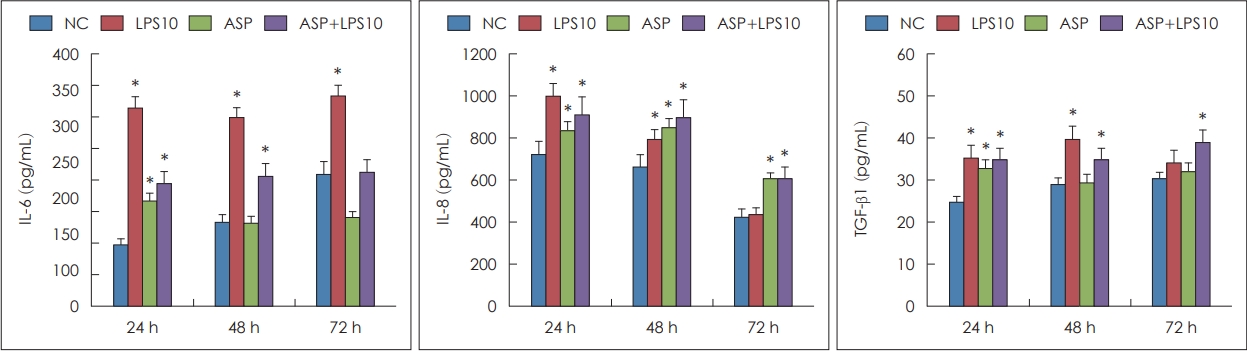
A. fumigatusņÖĆ LPSņØś ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņØś IL-6, IL-8, TGF-╬▓1 ņāØņä▒ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź
ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ĆļŖö IL-6, IL-8, TGF-╬▓1ņØś ņĀĢļ¤ēņĀü ļČäņäØņØä enzyme-linked immunosorbent assayļ▓Ģņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. ļ░░ņ¢æ 24ņŗ£Ļ░ä Ļ▓ĮĻ│╝ĒĢ£ Ļ▓ĮņÜ░ A. fumigatus, LPS Ēś╣ņØĆ ņØ┤ ļæÉ Ļ░Ćņ¦Ćļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ IL-6, IL-8, TGF-╬▓1ņØś ņāØņä▒ņØ┤ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż. ļ░░ņ¢æ 48ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢ£ Ļ▓ĮņÜ░ LPS, A. fumigatusņÖĆ LPSļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ ņäĖ Ļ░Ćņ¦Ć ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś ņāØņä▒ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, ļ░░ņ¢æ 72ņŗ£Ļ░äņØś Ļ▓ĮņÜ░ IL-6ļŖö LPSļĪ£ ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░, IL-8ņØĆ A. fumigatus, A. fumigatusņÖĆ LPSļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░, TGF-╬▓1ņØĆ A. fumigatusņÖĆ LPSļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż(Fig. 2).
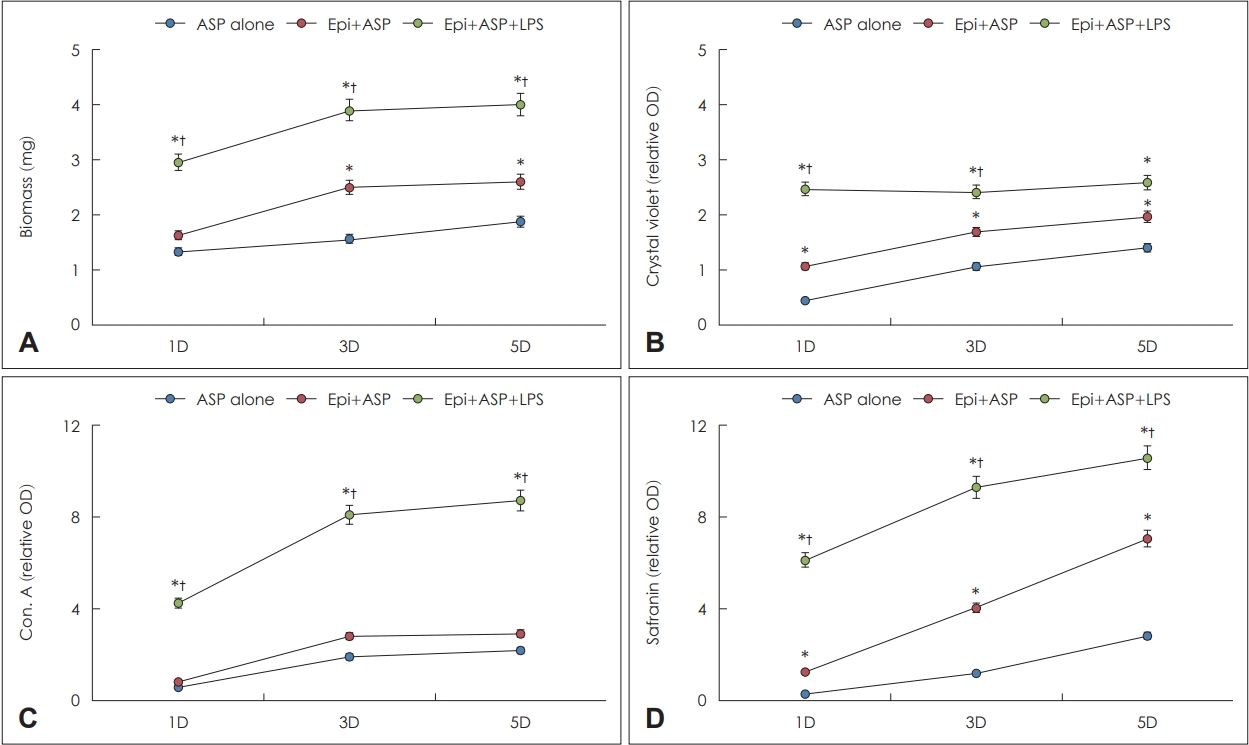
LPSĻ░Ć ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æļÉ£ A. fumigatus ņāØļ¼╝ļ¦ē ĒśĢņä▒ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź
A. fumigatusņÖĆ LPSļź╝ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ ņāØļ¼╝ļ¦ēņØś ļ¼┤Ļ▓īļŖö ļ░░ņ¢æ 1ņØ╝ņ¦Ė(3.0┬▒0.7 mg)ļČĆĒä░ ļ╣äĻ░ĢņāüĒö╝ņäĖĒż ņŚåņØ┤ A. fumigatus ļŗ©ļÅģ ļ░░ņ¢æ(1.3┬▒0.4 mg)ĒĢśĻ▒░ļéś, ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatus ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░(1.6┬▒0.4 mg)ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļ¼┤Ļ▒░ņøĀņ£╝ļ®░, ņāØļ¼╝ļ¦ēņØś ļ¼┤Ļ▓īļŖö ļ░░ņ¢æņŗ£Ļ░äņØś Ļ▓ĮĻ│╝ņŚÉ ļö░ļØ╝ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż(Fig. 3A). ņāØļ¼╝ļ¦ēņØś ņäĖĒżņÖĖ ĻĖ░ņ¦łņØś ņĪ┤ņ×¼ņÖĆ ņāØņĪ┤ļŖźļĀźņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ņŗ£Ē¢ēĒĢ£ crystal violet ņŚ╝ņāēņØĆ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatusļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ ņ£ĀņØśĒĢśĻ▓ī ļ░£ĒśäņØ┤ ļåÆņĢśņ£╝ļ®░, LPSļź╝ ņČöĻ░ĆĒĢśļŖö Ļ▓ĮņÜ░ ļŹöņÜ▒ Ļ░ĢĒĢśĻ▓ī ļ░£ĒśäļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż(Fig. 3B). ņ¦äĻĘĀ ņäĖĒżļ▓ĮņŚÉ ņŚ╝ņāēļÉśļŖö concanavalin AņØś Ļ▓ĮņÜ░ A. fumigatusņÖĆ LPSļź╝ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ ļ░░ņ¢æ 1ņØ╝ņ¦Ė(4.3┬▒1.4)ļČĆĒä░ ļ╣äĻ░ĢņāüĒö╝ņäĖĒż ņŚåņØ┤ A. fumigatus ļŗ©ļÅģ ļ░░ņ¢æ(0.6┬▒0.3)ĒĢśĻ▒░ļéś, ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatus ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░(0.8┬▒0.4)ļ│┤ļŗż Ļ░ĢĒĢśĻ▓ī ņŚ╝ņāēļÉśņŚłņ£╝ļéś, LPSņŚåņØ┤ ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ņØś ļæÉ ĻĄ░Ļ░äņŚÉļŖö ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Fig. 3C). ņāØļ¼╝ļ¦ē ņĪ┤ņ×¼ļź╝ Ļ░äņĀæņĀüņ£╝ļĪ£ ļéśĒāĆļé╝ ņłś ņ׳ļŖö safranin ņŚ╝ņāēņØś Ļ▓ĮņÜ░ A. fumigatusņÖĆ LPSļź╝ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ ļ░░ņ¢æ 1ņØ╝ņ¦Ė(6.1┬▒1.8)ļČĆĒä░ ļŗżļźĖ ļæÉ ĻĄ░ļ│┤ļŗż Ļ░ĢĒĢśĻ▓ī ņŚ╝ņāēļÉśņŚłņ£╝ļ®░, ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatusļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░(1.3┬▒0.5)ņŚÉļÅä ļ░░ņ¢æ 1ņØ╝ņ¦ĖļČĆĒä░ A. fumigatus ļŗ©ļÅģņØś ļ░░ņ¢æņØś Ļ▓ĮņÜ░(0.4┬▒0.3)ļ│┤ļŗż Ļ░ĢĒĢśĻ▓ī ņŚ╝ņāēļÉśņŚłļŗż(Fig. 3D).
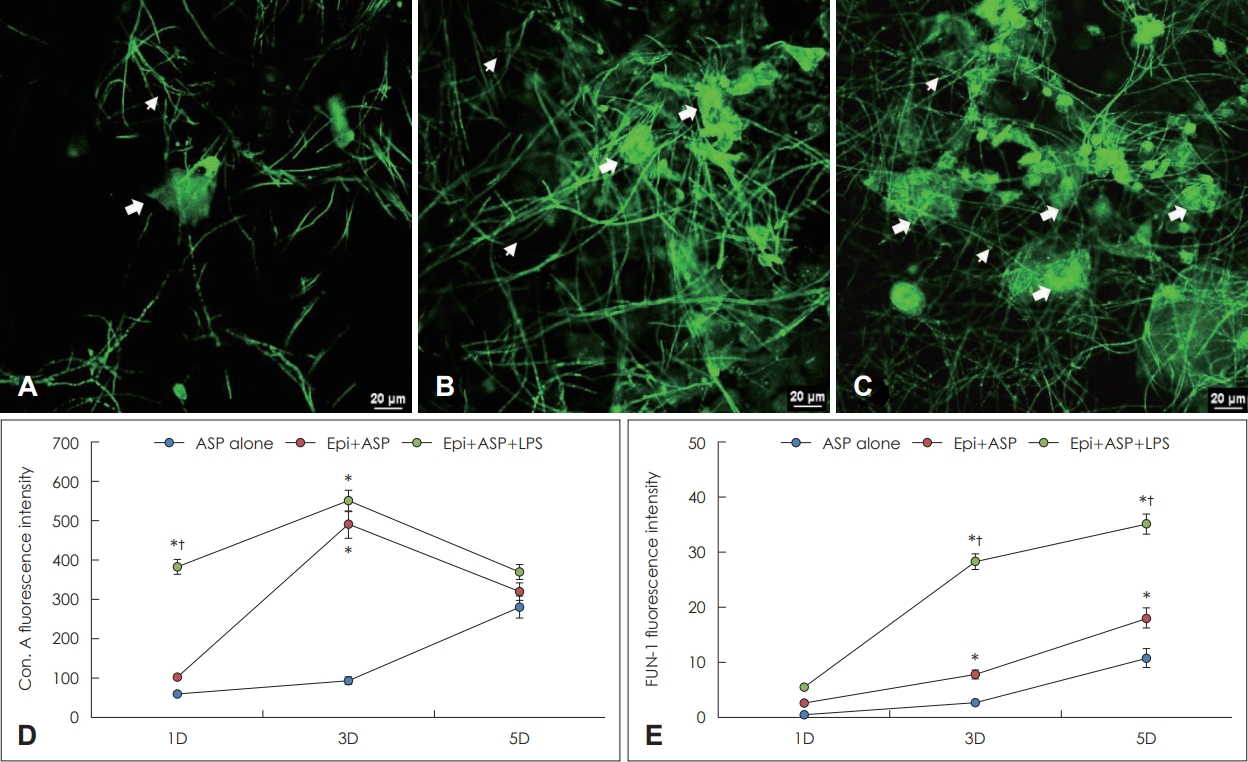
A. fumigatus ņāØļ¼╝ļ¦ēņØś ņŻ╝ņé¼ĒśĢ Ļ│Ąņ┤łņĀÉ ļĀłņØ┤ņĀĆ Ēśäļ»ĖĻ▓ĮņØä ņØ┤ņÜ®ĒĢ£ ĒÖĢņØĖ
ņ¦äĻĘĀ ņāØļ¼╝ļ¦ēņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ņ¦äĻĘĀ ņäĖĒżļ▓ĮņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ĒāäņłśĒÖöļ¼╝Ļ│╝ ļ░śņØæĒĢśļŖö concanavalin AņÖĆ ļīĆņé¼Ļ░Ć ĒÖ£ļ░£ĒĢśĻ▓ī ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö ņäĖĒżņ¦łņŚÉ ņŚ╝ņāēļÉśļŖö FUN-1 ņŚ╝ņāēņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. Concanavalin AņØś Ļ▓ĮņÜ░ A. fumigatusņÖĆ LPSļź╝ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ ļ░░ņ¢æ 1ņØ╝ņ¦Ė(382.7┬▒136.1)ļŖö ļŗżļźĖ ļæÉ ĻĄ░ļ│┤ļŗż Ļ░ĢĒĢśĻ▓ī ņŚ╝ņāēļÉśņŚłņ£╝ļ®░(59.8┬▒18.0Ļ│╝ 103.1┬▒34.1), ļ░░ņ¢æ 3ņØ╝ņ¦ĖņŚÉļŖö ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatusļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ LPSĻ░Ć ņāØļ¼╝ļ¦ē ĒśĢņä▒ņŚÉ ņČöĻ░ĆņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ļ¬╗ĒĢśņśĆņ£╝ļ®░(Fig. 4A-C), ļ░░ņ¢æ 5ņØ╝ņ¦ĖļŖö ņäĖ ĻĄ░Ļ░äņØś ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. Fun-1 ņŚ╝ņāēņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 1ņØ╝ņ¦ĖņŚÉļŖö ņäĖ ĻĄ░Ļ░äņØś ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļéś, 3ņØ╝ņ¦ĖļČĆĒä░ A. fumigatusņÖĆ LPSļź╝ ļ╣äĻ░ĢņāüĒö╝ ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ ļŗżļźĖ ļæÉ ĻĄ░ļ│┤ļŗż Ļ░ĢĒĢśĻ▓ī ņŚ╝ņāēļÉśņŚłņ£╝ļ®░, ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatusļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ļ░░ņ¢æ 3ņØ╝ņ¦ĖļČĆĒä░ A. fumigatus ļŗ©ļÅģņØś ļ░░ņ¢æņØś Ļ▓ĮņÜ░ļ│┤ļŗż Ļ░ĢĒĢśĻ▓ī ņŚ╝ņāēļÉśņŚłļŗż(Fig. 4D and E).
Ļ│Ā ņ░░
AspergillusļŖö ļ¦īņä▒ļČĆļ╣äļÅÖņŚ╝ņØś ļ╣äņ”ÖņŚÉņä£ ļ░░ņ¢æļÉśļ®░ ņ¦äĻĘĀĻĄ¼ņØś ņŻ╝ļÉ£ ņøÉņØĖĻĘĀņ£╝ļĪ£ ņ¦äĻĘĀņä▒ ļ╣äļČĆļ╣äļÅÖ ņ¦łĒÖśņŚÉņä£ ĒØöĒ׳ ļ░£Ļ▓¼ļÉśļ®░, ņĢäņŖżĒÄśļź┤ĻĖĖļŻ©ņŖżņ”Ø(aspergillosis)ņØ┤ļéś ĻĖ░Ļ┤Ćņ¦Ć ņ▓£ņŗØ ĒÖśņ×ÉņØś ĻĖ░ļÅäņŚÉņä£ļÅä ĒØöĒ׳ ļ░£Ļ▓¼ļÉ£ļŗż[13-15]. ĒśĖĒØĪņØä ĒåĄĒĢ┤ ĒĢśļŻ© ņłśļ░▒ Ļ░£ņØś A. fumigatus Ēżņ×ÉĻ░Ć ĒØĪņ×ģļÉśņ¢┤ ĒśĖĒØĪĻĖ░ ņĀÉļ¦ēĻ│╝ ņĀæņ┤ēĒĢśĻ▓ī ļÉśļ®░, ņäĀņ▓£ņä▒ Ēś╣ņØĆ Ēøäņ▓£ņä▒ ļ®┤ņŚŁļ░śņØæņØä ĒåĄĒĢ┤ ņĀ£Ļ▒░ļÉśĻ▒░ļéś ļŗżņ¢æĒĢ£ ņŚ╝ņ”Øļ░śņØæņØä ņ£Āļ░£ĒĢśĻ▓ī ļÉ£ļŗż. A. fumigatusļŖö ĒśĖĒØĪņāüĒö╝ņäĖĒżņØś dectin-1 ņłśņÜ®ņ▓┤ Ļ▓░ĒĢ®ĒĢśņŚ¼ MyD88/NF-╬║B Ēś╣ņØĆ PI3K/p38/ERK1/2 ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äņØś ņŚ░ņćäļ░śņØæņØä ĒåĄĒĢ┤ Ļ░üņóģ ņé¼ņØ┤ĒåĀņ╣┤ņØĖĻ│╝ ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØś ņāØņé░ņØä ņ£Āļ░£ĒĢ£ļŗż[16]. ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņØś protease activated receptor, toll-like receptorļéś C-type lectin-like receptorņÖĆ Ļ░ÖņØĆ Ēī©Ēä┤ ņØĖņŗØ ņłśņÜ®ņ▓┤ņÖĆ Ļ▓░ĒĢ®ĒĢśņŚ¼ NF-╬║BņÖĆ MAPK ļō▒ņØś ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äļź╝ ĒåĄĒĢ┤ ņāüĒö╝ņäĖĒżņØś ĒÖ£ņä▒ĒÖöļź╝ ņ£ĀļÅäĒĢśņŚ¼ ĻĄŁņåī ņŚ╝ņ”Øļ░śņØæņØä ņ£Āņ¦Ć ņĢģĒÖöņŗ£Ēé¼ ņłś ņ׳ļŗż[4,17]. ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØĖ IL-6, ĒśĖņżæĻĄ¼ ĒÖöĒĢÖņŻ╝ņä▒ņØĖņ×ÉņØĖ IL-8, ĒśĖĒØĪņāüĒö╝ņäĖĒżņØś ņäĖĒżņÖĖ ĻĖ░ņ¦ł ĒśĢņä▒Ļ│╝ ņāüĒö╝ Ļ░äņŚĮņØ┤Ē¢ēņØä ņ£ĀļÅäĒĢśļŖö TGF-╬▓1ņØĆ A. fumigatus Ēżņ×É ņ▓śļ”¼ 24ņŗ£Ļ░äļČĆĒä░ ļ¬©ļæÉ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, IL-8ņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 72ņŗ£Ļ░äĻ╣īņ¦Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. ĻĘĖ ņøÉņØĖņØä ņĀĢĒÖĢĒ׳ ņäżļ¬ģĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļéś IL-8ņØś ņ”ØĻ░ĆļŖö ņÖĖļČĆņŚÉņä£ ņ╣©ņ×ģĒĢ£ ļ│æņøÉņä▒ ļ¼╝ņ¦łņØś ņĀ£Ļ▒░ņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ĒśĖņżæĻĄ¼ņØś ņØ┤ņŻ╝ļź╝ ņ£ĀļÅäĒĢśņŚ¼ ņ¦äĻĘĀņŚÉ ļīĆĒĢ£ ņØĖņ▓┤ ļ░®ņ¢┤ĻĖ░ņĀäņØä ņ£Āņ¦Ć, Ļ░ĢĒÖöņŗ£Ēé¼ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ĻĘĖļ×īņØīņä▒ĻĘĀ ņäĖĒżļ▓ĮņØś ņŻ╝ņä▒ļČäņØĖ LPS ļśÉĒĢ£ ļ╣äĻ░ĢņĀÉļ¦ēņØś ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łĻ│╝ ņĀÉņĢĪņ£ĀņĀäņ×ÉņØś ļ░£ĒśäņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ£Āņé¼ĒĢśĻ▓ī IL-6, IL-8, TGF-╬▓ņØś ņāØņä▒ņØä ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░Ćņŗ£ņ╝░ļŗż[18]. ĒĢśņ¦Ćļ¦ī ņāüĒö╝ņäĖĒżļź╝ ņ¦äĻĘĀ Ēżņ×ÉņÖĆ LPSļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ņāØņä▒ņØś ņāüņŖ╣ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŖöļŹ░ ņØ┤ļŖö ņ¦äĻĘĀ Ēżņ×ÉņÖĆ LPS ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢśļŖö Ļ▓ĮņÜ░ ņ¦äĻĘĀ ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒ņŚÉ ņØśĒĢ£ ļīĆņé¼ĒÖ£ļÅÖņØś Ļ░ÉņåīņŚÉ ĻĖ░ņØĖĒĢśĻ▒░ļéś, ļæÉ Ļ░Ćņ¦Ć ļ¼╝ņ¦łņØ┤ ļÅÖņŗ£ņŚÉ ņāüĒö╝ņäĖĒż ņ×æņÜ®ĒĢśņŚ¼ ņäĖĒżļÅģņä▒ņØä ņ”ØĻ░Ćņŗ£Ēé┤ņŚÉ ĻĖ░ņØĖĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ĒśĖĒØĪĻĖ░ Ļ░ÉņŚ╝ņŚÉ ņ׳ņ¢┤ ņäĖĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØ┤ ĒĢŁņāØņĀ£ ļé┤ņä▒ Ēś╣ņØĆ ņ╣śļŻīņŚÉ ņל ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņØś ņøÉņØĖņ£╝ļĪ£ ņĢīļĀżņ¦Ćļ®┤ņä£ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņŚÉ ļīĆĒĢ┤ņä£ļÅä Ļ┤Ćņŗ¼ņØä Ļ░Ćņ¦ĆĻ▓ī ļÉśņŚłļŗż. ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØś Ļ▓ĮņÜ░ļÅä ļ╣äĻ░Ģ ņäĖņ▓ÖĻ│╝ Ļ░ÖņØĆ ļ¼╝ļ”¼ņĀü ņ╣śļŻīļéś ĒĢŁņ¦äĻĘĀņĀ£ļĪ£ ņ╣śļŻīĻ░Ć ļÉśņ¦Ć ņĢŖļŖö ļČłņØæņä▒ ņ¦łĒÖśņØś ņøÉņØĖņ£╝ļĪ£ ņ×äņāüņĀü ņØśņØśļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[19]. A. fumigatus ņāØļ¼╝ļ¦ēņØĆ ņśłĻ░üņØä ņØ┤ļŻ©ļŖö ĻĘĀņé¼ņØś ĒÅēĒśĢ Ēś╣ņØĆ ĻĄÉņ░© ĒśĢĒā£ņØś ĻĄ░ņ¦æņØ┤ ņäĖĒżņÖĖ ĻĖ░ņ¦łĻ│╝ ņäĖĒżņÖĖ Ļ│ĀļČäņ×É ļ¼╝ņ¦łļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ļČĆņ£Ā ĒśĢĒā£ņØś ņ¦äĻĘĀļ│┤ļŗż ļīĆņé¼ĒÖ£ļÅÖņØ┤ Ļ░ÉņåīĒĢśņŚ¼ ĒĢŁņ¦äĻĘĀņĀ£ņŚÉ ļīĆĒĢ£ Ļ░ĢĒĢ£ ņĀĆĒĢŁņä▒ņØä Ļ░Ćņ¦ĆĻ▓ī ļÉ£ļŗż[12]. A. fumigatus Ēżņ×ÉņØś ļČĆņ░®Ļ│╝ ļ░£ņĢäĻ░Ć ņØ┤ļŻ©ņ¢┤ņ¦Ćļ®┤ņä£ ņäĖĒżņÖĖ ĻĖ░ņ¦łĻ│╝ ĒĢ©Ļ╗ś ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņ£╝ļĪ£ ņä▒ņłÖļÉśļŖö Ļ│╝ņĀĢņØĆ ņĄ£ņåī 24-34ņŗ£Ļ░äņØ┤ ņåīņÜöļÉ£ļŗż[12]. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¦äĻĘĀ ļ░░ņ¢æ Ēøä 5ņØ╝Ļ╣īņ¦Ć ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż. A. fumigatus Ēżņ×Éļź╝ ĻĖ░Ļ┤Ćņ¦Ć ņāüĒö╝ņäĖĒż Ēś╣ņØĆ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒ņØ┤ ņ”ØĻ░ĆļÉ£ļŗż[11,20]. ņ¦äĻĘĀ Ēżņ×ÉļōżņØ┤ ĒśĖĒØĪņāüĒö╝ņäĖĒż Ēæ£ļ®┤ņŚÉ ļČĆņ░®ļÉ£ Ēøä ĻĘĀņé¼ņØś ņ”ØņŗØĻ│╝ ĒĢ©Ļ╗ś ņäĖĒżņÖĖ ĻĖ░ņ¦łņØ┤ ĒśĢņä▒ļÉśļ®┤ņä£ ņ¦äĻĘĀ ĻĄ░ņ¦æņØ┤ ĒśĢņä▒ļÉśĻ│Ā ņāØļ¼╝ļ¦ēņØś ĻĄ¼ļ®Ź(pore)Ļ│╝ ļé┤ļČĆ ņ▒äļäÉņØä ĒśĢņä▒ĒĢśļ®┤ņä£ ņ¦äĻĘĀ ņāØļ¼╝ļ¦ēņØ┤ ņāüĒö╝ņäĖĒżļź╝ ļŹ«Ļ▓ī ļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ A. fumigatusņÖĆ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ A. fumigatus ļŗ©ļÅģ ļ░░ņ¢æņØś Ļ▓ĮņÜ░ļ│┤ļŗż ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒ņØ┤ ļ░░ņ¢æ 5ņØ╝Ļ╣īņ¦Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ”ØĻ░ĆļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ļ¦īņä▒ļČĆļ╣äļÅÖņŚ╝ ĒÖśņ×ÉņØś ļ╣äĻ░Ģ ņĀÉļ¦ēņŚÉņä£ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēĻ│╝ ņäĖĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØ┤ Ļ│ĄņĪ┤ĒĢ©Ļ│╝ ļÅÖņŗ£ņŚÉ ļ╣äĻ░Ģ ļé┤ ņäĖĻĘĀņŚÉ ņØśĒĢ£ ņāüĒö╝ņäĖĒżņØś ņåÉņāüņØ┤ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒ņØä ņ┤ēņ¦äņŗ£Ēé¼ ņłś ņ׳ļŗż[7,8]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä LPSņÖĆ ņ¦äĻĘĀņØä ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ A. fumigatus ļŗ©ļÅģ Ēś╣ņØĆ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatus ļ░░ņ¢æĒĢ£ Ļ▓ĮņÜ░ ļ│┤ļŗż ļ¦ÄņØĆ ņ¢æņØś ņ¦äĻĘĀņä▒ņāØļ¼╝ļ¦ēņØ┤ ĒśĢņä▒ļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņØś Ļ▓ĮņÜ░ Staphylococcus [8]ļéś Pseudomonas [21]ņÖĆ Ļ░ÖņØĆ ĻĘĀņóģĻ│╝ ņ¦äĻĘĀņØä ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ ļ╣äļČĆļ╣äļÅÖ ņĀÉļ¦ēņØś ņäĀņ▓£ņä▒ ļ®┤ņŚŁļ░®ņ¢┤ĻĖ░ņĀäņØś ņåÉņāü ņ£ĀļÅäņÖĆ ņĀÉļ¦ēņŚ╝ņ”Øļ░śņØæņØś ņĢģĒÖöļź╝ ĒåĄĒĢ┤ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ÉĻ│╝ ļŗ¼ļ”¼ ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓ĮņÜ░ ĻĘĖļ×īņØīņä▒ĻĘĀ ļé┤ļÅģņåīņØĖ LPSļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ¦äĻĘĀ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ĒÖĢņØĖĒĢśņśĆļŗż. LPSņØś Ļ▓ĮņÜ░ ļśÉĒĢ£ ĻĘĀņóģĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņ¦äĻĘĀ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ│żļŖöļŹ░ ņØ┤ļŖö LPS ļśÉĒĢ£ ĻĖ░ņĪ┤ņØś ĻĘĀņóģĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņāüĒö╝ņäĖĒżņØś ņåÉņāüņØä ņ¦üņĀæ ņ£ĀļÅäĒĢśĻ▒░ļéś, LPSĻ░Ć ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņØś ņäĖĒżņÖĖ ĻĖ░ņ¦ł ĒśĢņä▒ņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö TGF-╬▓1ņØś ņāØņä▒ņØä ņ”ØĻ░Ćņŗ£Ēé┤ņ£╝ļĪ£ņŹ© ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä ņ£ĀļÅäĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ļ│Ėļŗż. ĒĢśņ¦Ćļ¦ī Ļ│Ąņ┤łņĀÉ ļĀłņØ┤ņĀĆ Ēśäļ»ĖĻ▓ĮņØś Ļ▓ĮņÜ░ ņäĖĒżņÖĖ ĻĖ░ņ¦łņØä ņŚ╝ņāēĒĢśļŖö concanavalin AņØś ĒśĢĻ┤æĻ░ĢļÅäĻ░Ć ļ░░ņ¢æ 5ņØ╝ņ¦Ė Ļ░ÉņåīĒĢśņśĆļŖöļŹ░ ņØ┤ļŖö LPSņÖĆ ņ¦äĻĘĀņØś ĒĢ®ļÅÖļ░░ņ¢æ ĻĖ░Ļ░äļÅÖņĢł ļ░░ņ¢æņĢĪņØä ļ│┤ņČ®ĒĢśĻ▒░ļéś ĻĄÉņ▓┤ĒĢśņ¦Ć ņĢŖņĢä ņäĖĒżņÖĖ ĻĖ░ņ¦ł ĒśĢņä▒ņØä ņ£äĒĢ£ ņČ®ļČä ņĪ░Ļ▒┤ņØä ļ¦īņĪ▒ņŗ£Ēéżņ¦Ć ļ¬╗ĒĢ©ņŚÉ ĻĖ░ņØĖĒĢĀ Ļ▓āņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓ĮņÜ░ ņ▓┤ņÖĖ ņŚ░ĻĄ¼ļĪ£ ņ¦äĒ¢ēļÉśņ¢┤ ņØĖņ▓┤ ļ╣äĻ░ĢņĀÉļ¦ēņŚÉņä£ ņØ╝ņ¢┤ļéśļŖö ņāüĒö╝ņäĖĒżļ┐É ņĢäļŗłļØ╝ ļŗżņ¢æĒĢ£ ĻĄ¼ņĪ░ņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżņØś ņāüĒśĖņ×æņÜ®ņØä ļ░śņśüĒĢĀ ņłś ņŚåņ¢┤ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä ņČ®ļČäĒ׳ ņØ┤ĒĢ┤ĒĢśĻ│Ā ņäżļ¬ģĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ ĒĢ£Ļ│äņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ļÅÖļ¼╝ ļ¬©ļŹĖņØä ņØ┤ņÜ®ĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.
ņØ┤ņāüņØś Ļ▓░Ļ│╝ļź╝ ņóģĒĢ®ĒĢ┤ ļ│┤ļ®┤ ļ╣äĻ░ĢņāüĒö╝ņäĖĒżļź╝ A. fumigatus, LPS ļŗ©ļÅģ Ēś╣ņØĆ A. fumigatusņÖĆ LPSļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ IL-6, IL-8, TGF-╬▓1 ļō▒ņØś ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦ł ņāØņä▒ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļéś A. fumigatusņÖĆ LPSļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢśĻ▒░ļéś ļŗ©ļÅģ ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ ņāØņä▒ļÉśļŖö ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØś ņ¢æņŚÉļŖö ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ļ╣äĻ░ĢņāüĒö╝ņäĖĒżņÖĆ A. fumigatusļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒ņØ┤ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, A. fumigatusņÖĆ LPSļź╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢśļŖö Ļ▓ĮņÜ░ ņ¦äĻĘĀņä▒ ņāØļ¼╝ļ¦ēņØś ĒśĢņä▒ņØ┤ ļŹöņÜ▒ Ļ░ĢĒĢśĻ▓ī ņ¦äĒ¢ēļÉśņŚłļŗż. ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ĒśĖĒØĪĻĖ░ ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņØś Ļ▓ĮņÜ░ ĒśĖĒØĪĻĖ░ ļé┤ ņĪ┤ņ×¼ĒĢśļŖö ņäĖĻĘĀĻ│╝ ņ¦äĻĘĀņØś ņāüĒśĖņ×æņÜ®ņ£╝ļĪ£ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØ┤ ĒÖ£ļ░£ĒĢśĻ▓ī ņØ┤ļŻ©ņ¢┤ņ¦Ćļ®░, ņØ┤ļĪ£ ņØĖĒĢ┤ ņŚ╝ņ”Øļ░śņØæņØ┤ ņ£Āņ¦Ć ņĢģĒÖöļÉĀ ņłś ņ׳ņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.