ņä£ ļĪĀ
ņ¦Ćļé£ ņłśņŗŁ ļģäĻ░ä ļ¦ÄņØĆ ļæÉĻ▓ĮļČĆņĢö, ĒŖ╣Ē׳ ņØĖļæÉ ļ░Å ĒøäļæÉņĢöņØś ņ╣śļŻīņŚÉ ņ׳ņ¢┤ ĻĖ░Ļ┤Ć ļ│┤ņĪ┤(organ preservation)ņØä ņ£äĒĢ£ ĒĢŁņĢö ļ░®ņé¼ņäĀ ņ╣śļŻīņØś ļ╣łļÅäĻ░Ć ņĀÉņ░© ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŖö ņČöņäĖņØ┤ļéś, ņäżņĢöņØä ĒżĒĢ©ĒĢ£ ĻĄ¼Ļ░ĢņĢöņŚÉ ņ׳ņ¢┤ņä£ļŖö ņŚ¼ņĀäĒ׳ Ļ┤æļ▓öņ£äĒĢ£ ņłśņłĀņĀü ņĀłņĀ£Ļ░Ć ņØ╝ņ░© ņ╣śļŻīļĪ£ ņØĖņĀĢļ░øĻ│Ā ņ׳ļŗż[1,2]. ņØ┤ļ¤¼ĒĢ£ ņäżņĢöņØś ņłśņłĀņĀü ņĀłņĀ£ņŚÉ ņ׳ņ¢┤ņä£ļŖö ņČ®ļČäĒĢ£ ļ│ĆņŚ░ņØä ĒÖĢļ│┤ĒĢśļŖö Ļ▓āņØ┤ Ļ░Ćņן ņżæņÜöĒĢ£ ņśłĒøä ņØĖņ×É ņżæ ĒĢśļéśņØĖļŹ░, ņØ┤ļź╝ ņ£äĒĢ┤ņä£ļŖö ņĀüņ¢┤ļÅä ņ£ĪņĢłņĀüņ£╝ļĪ£ ĒÖĢņØĖļÉśļŖö ņóģņ¢æņØś Ļ▓ĮĻ│äļ│┤ļŗż 1.5 cmĻ░Ćļ¤ēņØś ņČöĻ░ĆņĀüņØĖ ņĀłņĀ£Ļ░Ć ĒĢäņÜöĒĢśļ®░[3,4], ļö░ļØ╝ņä£ ņĄ£ņóģņĀüņØĖ ĻĄ¼Ļ░ĢņäżņØś Ļ▓░ņåÉ ļ▓öņ£äļŖö ņŗżņĀ£ ņóģņ¢æņØś Ēü¼ĻĖ░ļ│┤ļŗż ņāüļŗ╣Ē׳ ĒÖĢņןļÉśĻ▓ī ļÉ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ņØ┤ņ£ĀļĪ£ ņøÉļ░£ņĢöņØś Ēü¼ĻĖ░Ļ░Ć ņĢäņŻ╝ ņ×æņØĆ Ļ▓ĮņÜ░ļź╝ ņĀ£ņÖĖĒĢśĻ│ĀļŖö ļīĆļČĆļČä Ļ▓░ņåÉņØś Ēü¼ĻĖ░ņÖĆ ņ£äņ╣śņŚÉ ļö░ļźĖ ņĀüņĀłĒĢ£ ņ×¼Ļ▒┤ņłĀņØ┤ ĒĢäņÜöĒĢśĻ▓ī ļÉ£ļŗż[5].
ņĄ£ĻĘ╝ ļ»ĖņäĖĒśłĻ┤Ć ņłśņłĀņØ┤ ļ░£ļŗ¼ĒĢ©ņŚÉ ļö░ļØ╝ ĒśĆņØś ņ×¼Ļ▒┤ņŚÉ ņ׳ņ¢┤ņä£ļŖö ņĀäņÖä ņ£Āļ”¼ Ēö╝ĒīÉĻ│╝ ņÖĖņĖĪ ļīĆĒć┤ Ēö╝ĒīÉ ļō▒ņØś ĻĘ╝ļ¦ē Ēö╝ļČĆ ņ£Āļ”¼ Ēö╝ĒīÉņØ┤ ļäÉļ”¼ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż[6,7]. ņØ┤ļ¤¼ĒĢ£ ņ£Āļ”¼ Ēö╝ĒīÉņłĀņØĆ Ēü░ Ļ▓░ņåÉņØ┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ņČ®ļČäĒĢ£ ņÜ®ņĀüņØä ņĀ£Ļ│ĄĒĢĀ ņłś ņ׳ņ£╝ļ®░, ĻĖ░ļŖźņĀüņØĖ ņĖĪļ®┤ņŚÉņä£ļÅä ļ╣äĻĄÉņĀü ņ¢æĒśĖĒĢ£ ņŚ░ĒĢś ļ░Å ņĪ░ņØī ĻĖ░ļŖźņØä ļ│┤ņØĖļŗżļŖö ņןņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[2,8]. ĒĢśņ¦Ćļ¦ī Ļ▓░ņåÉņØś Ēü¼ĻĖ░Ļ░Ć ņżæļō▒ļÅäņØĖ ĻĄ¼Ļ░ĢņØś Ļ▓░ņåÉņŚÉ ņ׳ņ¢┤ņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ĻĘ╝ļ¦ē Ēö╝ļČĆ Ēö╝ĒīÉņØś Ēü¼ĻĖ░Ļ░Ć Ļ▓░ņåÉ Ēü¼ĻĖ░ņŚÉ ļ╣äĒĢ┤ ļŗżņåī Ēü░ Ļ▓ĮņÜ░Ļ░Ć ņ׳ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ Ļ▓ĮņÜ░ Ēö╝ĒīÉņØä ĒåĄĒĢ£ ņ×¼Ļ▒┤ņØ┤ ņśżĒ׳ļĀż ļé©ņĢäņ׳ļŖö ņĀĢņāü ĻĄ¼Ļ░ĢņäżņØś ņøĆņ¦üņ×äņØä ņĀĆĒĢ┤ĒĢśņŚ¼ ļ¦īņĪ▒ņŖżļ¤¼ņÜ┤ ņ×¼Ļ▒┤ Ļ▓░Ļ│╝ļź╝ ļé│ņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ĒØöĒ׳ ļ░£ņāØĒĢ£ļŗż[9].
ņĄ£ĻĘ╝ ņØ┤ņÖĆ Ļ░ÖņØĆ ņżæļō▒ļÅä Ēü¼ĻĖ░ņØś ĻĄ¼Ļ░Ģ ņ×¼Ļ▒┤ņŚÉ ņ׳ņ¢┤ ņØ╝ņ░© ļ┤ēĒĢ®ņØ┤ļéś ņ£Āļ”¼ Ēö╝ĒīÉņØś ļīĆņĢłņ£╝ļĪ£ ĒśæļČĆ Ēö╝ĒīÉ(buccal flap)ņØ┤ ļ¦ÄņØĆ Ļ┤Ćņŗ¼ņØä ļ¬©ņ£╝Ļ│Ā ņ׳ļŗż[9,10]. ĒśæļČĆ Ēö╝ĒīÉņØĆ Ēö╝ĒīÉņØś ņĪ░ņ¦ü ĻĄ¼ņä▒ ņĖĪļ®┤ņŚÉņä£ ĒśæĻĘ╝ ĻĘ╝ņĀÉļ¦ē Ēö╝ĒīÉ(buccinators myomucosal flap)ņ£╝ļĪ£ ļČłļ”¼ļŖöļŹ░, Ēö╝ĒīÉĻ▓Į(flap pedicle)ņØś ņ£äņ╣śņŚÉ ļö░ļØ╝ ņĀäļ░®, Ēøäļ░®, ņāüļ░®, ĒĢśļ░®ņ£╝ļĪ£ ĻĄ¼ļČäļÉĀ ņłś ņ׳ņ£╝ļ®░, Ēö╝ĒīÉĻ▓ĮņØ┤ ņŚåļŖö ļÅäņä£ĒśĢ Ēö╝ĒīÉ(island flap)ņØś ĒśĢĒā£ļĪ£ ņé¼ņÜ®ĒĢĀ ņłśļÅä ņ׳ļŗż[10]. ņØ┤ļōż ņżæ ĒśæļČĆ ļÅÖļ¦źņ£╝ļĪ£ļČĆĒä░ ĒśłĒ¢ē Ļ│ĄĻĖēņØä ļ░øļŖö Ēøäļ░® ĻĖ░ņĀĆ ĒśæĻĘ╝ ĻĘ╝ņĀÉļ¦ē Ēö╝ĒīÉ(posterior-based buccinators myomucosal flap)ņØĆ 1989ļģä Bozola ļō▒[11]ņŚÉ ņØśĒĢ┤ ņ▓śņØī ĻĖ░ņłĀļÉśņ¢┤ ĒØöĒ׳ Bozola Ēö╝ĒīÉņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ĒĢ┤ļŗ╣ Ēö╝ĒīÉņØĆ ļŗżņ¢æĒĢ£ ĒśĢĒā£ņØś ĒśæĻĘ╝ ĻĘ╝ņĀÉļ¦ē Ēö╝ĒīÉ ņżæ ĻĘĖ ņłĀĻĖ░Ļ░Ć Ļ░Ćņן Ļ░äļŗ©ĒĢśĻ│Ā, Ēö╝ĒīÉņØś ĒśłĒ¢ēņØä ļŗ┤ļŗ╣ĒĢśļŖö ĒśæļČĆ ļÅÖļ¦źņØś ņ£äņ╣śĻ░Ć Ļ▒░ņØś ĒĢŁņāü ņØ╝ņĀĢĒĢśņŚ¼ ļ¦żņÜ░ ņĢłņĀäĒĢ£ Ēö╝ĒīÉņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī Ēśäņ×¼Ļ╣īņ¦Ć ļīĆļČĆļČäņØś ĒśæĻĘ╝ ĻĘ╝ņĀÉļ¦ē Ēö╝ĒīÉņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņĢłļ®┤ ļÅÖļ¦źņØä Ļ│ĄĻĖē ĒśłĻ┤Ćņ£╝ļĪ£ ĒĢśļŖö ņĢłļ®┤ ļÅÖļ¦ź ĻĘ╝ņĀÉļ¦ē Ēö╝ĒīÉ(facial artery myomucosal flap)ņŚÉ ņ¦æņżæļÉśņ¢┤ ņÖöņ£╝ļ®░, Bozola Ēö╝ĒīÉņØś ņ£ĀņÜ®ņä▒ ļ░Å Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ļ¦ÄņØ┤ ļČĆņĪ▒ĒĢ£ ņŗżņĀĢņØ┤ļŗż[12-14]. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ĻĄ¼Ļ░ĢņäżņĢö ĒÖśņ×ÉņŚÉ ņ׳ņ¢┤ Bozola Ēö╝ĒīÉņØś ĻĖ░ņłĀņĀü Ļ░ĆļŖźņä▒Ļ│╝ ņłĀ Ēøä Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāü ļ░Å ļ░®ļ▓Ģ
ļīĆ ņāü
ļ│Ė ņŚ░ĻĄ¼ļŖö 2014ļģä 1ņøöļČĆĒä░ 2016ļģä 6ņøöĻ╣īņ¦Ć Bozola Ēö╝ĒīÉņØä ņØ┤ņÜ®ĒĢ┤ ĻĄ¼Ļ░Ģ ņ×¼Ļ▒┤ņłĀņØä ņŗ£Ē¢ēĒĢ£ 15ļ¬ģņØś ņäżņĢö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņĀäĒ¢źņĀüņ£╝ļĪ£ ņ¦äĒ¢ēļÉśņŚłļŗż(IRB No. 201805009002).
ļīĆņāü ĒÖśņ×ÉņØś ĒÅēĻĘĀ ļéśņØ┤ļŖö 58.5ņäĖ(20~87ņäĖ)ļĪ£ ņĀäņ▓┤ 15ļ¬ģ ņżæ ļé©ņ×ÉĻ░Ć 8ļ¬ģ(53.3%), ņŚ¼ņ×ÉĻ░Ć 7ļ¬ģ(46.7%)ņØ┤ņŚłļŗż. ņ×äņāü ļ│æĻĖ░ļŖö TNM ļ│æĻĖ░ņŚÉ ļö░ļØ╝ T1N0M0ņØĖ Ļ▓ĮņÜ░Ļ░Ć 1ņśł(6.7%)ņśĆņ£╝ļ®░ T2N0M0ņØĖ Ļ▓ĮņÜ░Ļ░Ć 11ņśł(73.3%), T3N0M0Ļ░Ć 3ņśł(20.0%)ņśĆļŗż(Table 1).
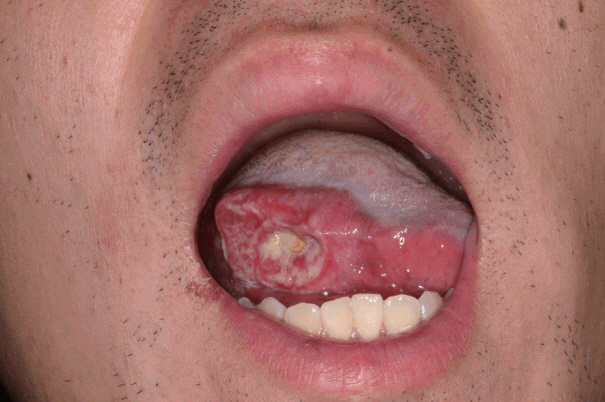
ļ¬©ļōĀ ĒÖśņ×ÉļŖö ņłśņłĀ ņĀä ĒÅēĻ░ĆļĪ£ ņĀäņØ┤ ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ£ ņ┤łņØīĒīī Ļ▓Ćņé¼, ņ╗┤Ēō©Ēä░ļŗ©ņĖĄņ┤¼ņśü, ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņ┤¼ņśü, ĻĘĖļ”¼Ļ│Ā ņ¢æņĀäņ×É ļ░®ņČ£ ļŗ©ņĖĄņ┤¼ņśüņłĀņØä ņŗ£Ē¢ē ļ░øņĢśņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņśüņāü Ļ▓Ćņé¼ņŚÉņä£ ņĀäņØ┤Ļ░Ć ĒÖĢņØĖļÉ£ Ļ▓ĮņÜ░ļŖö ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļ░░ņĀ£ļÉśņŚłļŗż. ņäżņĢöņØś ņ╣śļŻīļĪ£ļŖö ļ¬©ļōĀ ņśłņŚÉņä£ ņøÉļ░£ņĢöņØś ņ£ĪņĢłņĀü Ļ▓ĮĻ│äļĪ£ļČĆĒä░ 1.0~1.5 cmļź╝ ĒżĒĢ©ĒĢśļŖö ĒśĆ ļČĆļČä ņĀłņĀ£ņłĀĻ│╝ ĒĢ©Ļ╗ś ņśłļ░®ņĀü ņäĀĒāØņĀü Ļ▓ĮļČĆ ņĀłņĀ£ņłĀ(level I-III ļśÉļŖö I-IV)ņØ┤ ņŗ£Ē¢ēļÉśņŚłļŗż(Figs. 1 and 2).
Bozola Ēö╝ĒīÉņØś ņłśņłĀ ĻĖ░ļ▓Ģ
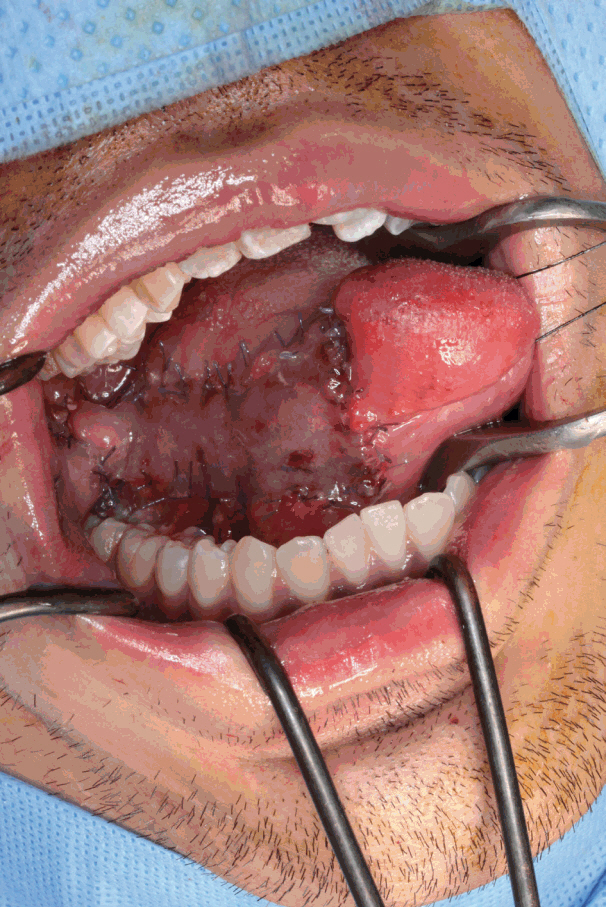
ļ¬©ļōĀ ņłśņłĀņØĆ ņĀäņŗĀļ¦łņĘ©ĒĢśņŚÉ ĒĢ£ ļ¬ģņØś ļæÉĻ▓ĮļČĆ ņÖĖĻ│╝ņØśņŚÉ ņØśĒĢ┤ ņŗ£Ē¢ēļÉśņŚłņ£╝ļ®░ 2.5ļ░░ ĒÖĢļīĆĻ▓ĮņØä ņ░®ņÜ®ĒĢ£ ņ¦üņĀæ ņŗ£ņĢ╝ņŚÉņä£ ņ¦äĒ¢ēļÉśņŚłļŗż. Ēö╝ĒīÉņØś Ēü¼ĻĖ░ļŖö Ļ│╝ĻĄÉņĀĢ ņŚåņØ┤ Ļ▓░ņåÉņØś Ēü¼ĻĖ░ņÖĆ Ļ▒░ņØś ļÅÖņØ╝ĒĢśĻ▓ī ļÅäņĢłĒĢśņśĆņ£╝ļ®░, Ēö╝ĒīÉ Ļ▒░ņāüņŗ£ ņØ┤ĒĢśņäĀĻ┤ĆņØś Ļ░£ĻĄ¼ļČĆļź╝ ņåÉņāüņŗ£Ēéżņ¦Ć ņĢŖļÅäļĪØ ņŻ╝ņØśĒĢśņśĆļŗż. Ēö╝ĒīÉņØś ņĀäļ░® Ļ▓ĮĻ│äļŖö ĒśæĻĄÉļĀ©(oral commissure)ņ£╝ļĪ£ļČĆĒä░ ņĄ£ņåī 1 cm Ēøäļ░®ņØ┤ ļÉśļÅäļĪØ, Ēøäļ░®ņ£╝ļĪ£ļŖö ņØĄļÅīĒĢśņĢģļ┤ēņäĀ(pterygomandibular raphe)ņØ┤ ļÉśļÅäļĪØ ĒĢśņśĆļŗż. ļśÉĒĢ£ Ēö╝ĒīÉņØś ĒÅŁņØĆ Ļ░ĆļŖźĒĢ£ ĒĢ£ 3.5 cmņØä ļäśņ¦Ć ņĢŖļÅäļĪØ ĒĢśņŚ¼ Ļ│ĄņŚ¼ļČĆņØś ņØ╝ņ░© ļ┤ēĒĢ®ņØ┤ Ļ░ĆļŖźĒåĀļĪØ ĒĢśņśĆļŗż. ĒśæļČĆ ņĀÉļ¦ēĻ│╝ ĒśæĻĘ╝ņØä ņĀłĻ░£ĒĢśĻ│Ā ĒśæĻĘ╝Ļ│╝ ĒśæļČĆ ņØĖļæÉĻĘ╝ļ¦ē ņé¼ņØ┤ņØś ņĖĄņØä ļö░ļØ╝ ņĀäļ░®ņŚÉņä£ Ēøäļ░®ņØä Ē¢źĒĢ┤ Ēö╝ĒīÉņØä Ļ▒░ņāüĒĢśņśĆļŗż. ņØĄļÅīĒĢśņĢģļ┤ēņäĀ ļ░öļĪ£ ņĀäļ░®ņŚÉļŖö ĒśæļČĆ ļÅÖļ¦źņØä ĒżĒĢ©ĒĢ£ Ēö╝ĒīÉņØś ĒśłĻ┤ĆĻ▓Į(vascular pedicle)ņØä ĒÖĢņØĖĒĢśĻ│Āņ×É ĒĢśņśĆņ£╝ļ®░, ņØ┤Ēøä Ļ▒░ņāüļÉ£ Ēö╝ĒīÉņØĆ Ļ│╝ļÅäĒĢ£ Ļ╝¼ņ×äņØ┤ ņāØĻĖ░ņ¦Ć ņĢŖļÅäļĪØ ņŻ╝ņØśļź╝ ĻĖ░ņÜĖņØ┤ļ®░ Ļ▓░ņåÉļČĆļĪ£ ĒÜīņĀäņŗ£ņ╝£ ļ┤ēĒĢ®ĒĢśņśĆļŗż(Fig. 3).
ĒÅēĻ░Ć ĒĢŁļ¬®
ņłśņłĀ ņĀä ĒÖśņ×ÉņØś ļéśņØ┤ņÖĆ ņä▒ļ│ä, ņ╣śņĢä ņāüĒā£, ņøÉļ░£ļ│æņåīņØś ņ×äņāü ļ│æĻĖ░ļź╝ ĒÅēĻ░ĆĒĢśņśĆļŗż. ņłśņłĀ ņżæ ņøÉļ░£ļ│æņåī ņĀ£Ļ▒░ņŚÉ ļö░ļźĖ Ļ▓░ņåÉņØś Ēü¼ĻĖ░, Ēö╝ĒīÉņØś Ēü¼ĻĖ░, Ēö╝ĒīÉ Ļ▒░ņāüņŚÉ Ļ▒Ėļ”¼ļŖö ņŗ£Ļ░ä, Ēö╝ĒīÉ ĒśłĻ┤ĆĻ▓ĮņØś ĒÖĢņØĖ ņŚ¼ļČĆ, Ļ│ĄņŚ¼ļČĆņØś ņ×¼Ļ▒┤ļ▓ĢņØä ņĪ░ņé¼ĒĢśņśĆņ£╝ļ®░ ņØ┤ņ░© ņłśņłĀļĪ£ Ēö╝ĒīÉĻ▓Į ņĀłĻ░£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŖöņ¦Ć ļśÉĒĢ£ ĒÖĢņØĖĒĢśņśĆļŗż. ņłśņłĀ Ēøä Ēö╝ĒīÉĻ│╝ Ļ┤ĆļĀ©ĒĢ£ ĒĢ®ļ│æņ”ØņØä ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ ĒśłņóģņØś ļ░£ņāØ ņŚ¼ļČĆņÖĆ, Ēö╝ĒīÉņØś Ļ┤┤ņé¼ ļō▒ņŚÉ ļīĆĒĢ┤ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņłĀ Ēøä 3Ļ░£ņøö Ļ▓Į ĻĄ¼Ļ░Ģ ņŚ┤ļ”╝ ņĀ£ĒĢ£(maximal interincisal opening) ļ░Å ĒśæĻĄÉļĀ©ņØś ļ╣äļīĆņ╣Ł ņŚ¼ļČĆ ļō▒ņŚÉ ļīĆĒĢ┤ ĒÅēĻ░ĆĒĢśņśĆļŗż.
Ļ▓░ Ļ│╝
ņłśņłĀ Ļ▓░Ļ│╝
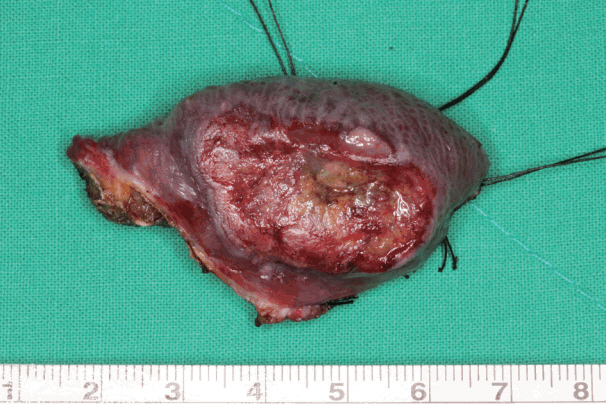
ņøÉļ░£ņĢö ņĀłņĀ£ Ēøä Ļ▓░ņåÉļČĆņØś ĒÅēĻĘĀ Ēü¼ĻĖ░ļŖö 5.5(4.0~6.5 cm)├Ś4.1 cm(3.0~5.0 cm)ņśĆĻ│Ā, Ēö╝ĒīÉņØś ĒÅēĻĘĀ Ēü¼ĻĖ░ļŖö 5.2(4.0~6.0 cm)├Ś3.4 cm(3.0~4.5 cm)ņØ┤ņŚłļŗż. Ēö╝ĒīÉ Ļ▒░ņāüņŚÉ Ļ▒Ėļ”░ ĒÅēĻĘĀ ņŗ£Ļ░äņØĆ 25.3ļČä(20~35ļČä)ņØ┤ņŚłņ£╝ļ®░, 12ņśł(80%)ņŚÉņä£ļŖö Ēö╝ĒīÉ Ļ▒░ņāü ņżæ ĒśæļČĆ ļÅÖļ¦ź ĒśłĻ┤ĆĻ▓ĮņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļéś, 3ņśł(20.0%)ņŚÉņä£ļŖö ĒśłĻ┤ĆĻ▓ĮņØś ņ¦üņĀæņĀüņØĖ ĒÖĢņØĖ ņŚåņØ┤, ĒśłĻ┤ĆĻ▓ĮņØ┤ ņ£äņ╣śĒĢśļŖö ņĪ░ņ¦üņĖĄņØä ĒżĒĢ©ĒĢśņŚ¼ Ēö╝ĒīÉņØä Ļ▒░ņāüĒĢśņśĆļŗż. ĒśæļČĆ Ļ│ĄņŚ¼ļČĆņØś Ļ▓░ņåÉņØĆ 14ņśł(93.3%)ņŚÉņä£ ņØ╝ņ░© ļ┤ēĒĢ®ņ£╝ļĪ£, 1ņśłņŚÉņä£ļŖö ĒśæļČĆ ņ¦Ćļ░®Ēī©ļō£(fat pad) Ēö╝ĒīÉņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ×¼Ļ▒┤ĒĢśņśĆļŗż. Bozola Ēö╝ĒīÉņØä ņØ┤ņÜ®ĒĢ£ ĻĄ¼Ļ░Ģ ņ×¼Ļ▒┤ ņØ┤Ēøä ņØ┤ņ░© ņłśņłĀļĪ£ Ēö╝ĒīÉĻ▓ĮņØä ņĀłļŗ©ĒĢ┤ņĢ╝ Ē¢łļŹś Ļ▓ĮņÜ░ļŖö ļ¬©ļæÉ 10ņśł(66.7%)ļĪ£, ņ╣śņĢäņŚÉ Ēö╝ĒīÉĻ▓ĮņØ┤ ņö╣Ē׳Ļ▒░ļéś ņ╣śņĢä ļ│┤ņ▓Āļ¼╝ ņé¼ņÜ®ņŚÉ ņןņĢĀĻ░Ć ļÉśņ¢┤ ņŗ£Ē¢ēļÉśņŚłļŗż(Table 2).
ņłśņłĀ Ēøä ĒĢ®ļ│æņ”Ø
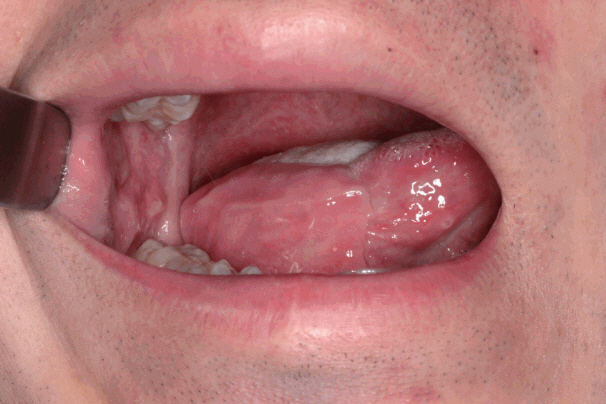
ņĀäņ▓┤ 15ļ¬ģņØś ĒÖśņ×É ņżæ ņłśņłĀ Ēøä Ļ│ĄņŚ¼ļČĆ ļśÉļŖö ņłśĒś£ļČĆņŚÉ ĒśłņóģņØ┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ļŖö 1ņśłļÅä ņŚåņŚłļŗż. 2ņśł(26.7%)ņŚÉņä£ Ēö╝ĒīÉņØś ļ│ĆņŚ░ļČĆņŚÉ ļČĆļČä Ļ┤┤ņé¼Ļ░Ć ļ░£ņāØĒĢśņśĆņ£╝ļéś, ņČöĻ░ĆņĀüņØĖ ņ╣śļŻī ņŚåņØ┤ ņĀĆņĀłļĪ£ ņ╣śņ£ĀļÉśņŚłņ£╝ļ®░, Ēö╝ĒīÉņØś ņÖäņĀä Ļ┤┤ņé¼Ļ░Ć ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ļŖö 1ņśłļÅä ņŚåņŚłļŗż. ņłśņłĀ Ēøä 2ņśł(13.3%)ņŚÉņä£ļŖö Ļ▓ĮļÅäņØś Ļ░£ĻĄ¼ņןņĢĀĻ░Ć ļ░£ņāØĒĢśņśĆņ£╝ļéś ņżæļō▒ļÅä ņØ┤ņāüņØś Ļ░£ĻĄ¼ņןņĢĀļź╝ ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ļŖö ņŚåņŚłņ£╝ļ®░, ĒśæĻĄÉļĀ© ļ╣äļīĆņ╣ŁņØĆ 1ņśłļÅä ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśļŗż(Table 3, Fig. 4).
Ļ│Ā ņ░░
ņĀĆņ×ÉļōżņØĆ ņØ┤ļ▓ł ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ĻĄ¼Ļ░ĢņäżņĢö ņłśņłĀ Ēøä ļ░£ņāØĒĢ£ ņżæļō▒ļÅäņØś ĻĄ¼Ļ░Ģ Ļ▓░ņåÉņŚÉ ņ׳ņ¢┤ Bozola Ēö╝ĒīÉņØ┤ļØ╝ļŖö ļ╣äĻĄÉņĀü Ļ░äļŗ©ĒĢśļ®┤ņä£ļÅä ņĢłņĀäĒĢ£ ņłĀņŗØņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀüņĀłĒĢ£ ĻĄ¼Ļ░Ģ ņ×¼Ļ▒┤ņØ┤ Ļ░ĆļŖźĒĢ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.
Ēö╝ĒīÉ Ļ▒░ņāüņŚÉ Ļ▒Ėļ”¼ļŖö ĒÅēĻĘĀ ņŗ£Ļ░äņØĆ 25.3ļČä(20~35ļČä)ņ£╝ļĪ£, Ferrari ļō▒[10]ņØś ņŚ░ĻĄ¼ņŚÉņä£ 20~40ļČäĻ░Ćļ¤ēņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ Ļ▓░Ļ│╝ņÖĆ ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ņ¦¦ņØĆ Ēö╝ĒīÉ Ļ▒░ņāü ņŗ£Ļ░äņØĆ ņ£Āļ”¼ Ēö╝ĒīÉņØś Ļ▓ĮņÜ░ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ņä£ļŖö ļ¼╝ļĪĀņØ┤Ļ│Ā, ņäżĻ│©ĒĢś Ēö╝ĒīÉ(infrahyoid flap)ņØ┤ļéś Ēä▒ļ░æ Ēö╝ĒīÉ(submental flap)Ļ│╝ Ļ░ÖņØĆ ņżæļō▒ļÅä Ēü¼ĻĖ░ņØś ĻĄ¼Ļ░Ģ ņ×¼Ļ▒┤ņŚÉ ņØ┤ņÜ®ļÉĀ ņłś ņ׳ļŖö ļŗżļźĖ ĻĄŁņåī Ēö╝ĒīÉņŚÉ ļ╣äĒĢśņŚ¼ņä£ļÅä ļŗżņåī ņ¦¦ņØĆ Ļ▓āņØĖļŹ░, ņØ┤ļŖö Bozola Ēö╝ĒīÉņłĀņØ┤ ņ£Āļ”¼ Ēö╝ĒīÉņłĀĻ│╝ ļŗ¼ļ”¼ ļ│Ąņ×ĪĒĢ£ ļ»ĖņäĖĒśłĻ┤Ć ņłśņłĀļ▓ĢņØä ĒĢäņÜöļĪ£ ĒĢśņ¦Ć ņĢŖĻ│Ā, Ļ▓░ņåÉļČĆņÖĆ Ļ│ĄņŚ¼ļČĆĻ░Ć ļ¬©ļæÉ ĻĄ¼Ļ░Ģ ļé┤ņŚÉ ņ׳ņ¢┤ ņłśņłĀ ļ▓öņ£ä(operation field)Ļ░Ć Ēü¼ņ¦Ć ņĢŖļŗżļŖö ņĀÉ ļĢīļ¼ĖņØ╝ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[9,15]. ņØ┤ļ¤¼ĒĢ£ ņ¦¦ņØĆ Ēö╝ĒīÉ Ļ▒░ņāü ņŗ£Ļ░äņØĆ ņĀäņ▓┤ ņłśņłĀ ņŗ£Ļ░äņØä ļŗ©ņČĢņŗ£ņ╝£ Ļ│ĀļĀ╣ņØ┤Ļ▒░ļéś ĻĖ░ņĀĆņ¦łĒÖśņØ┤ ļ¦ÄņĢä ņןņŗ£Ļ░äņØś ņĀäņŗĀļ¦łņĘ©ņŚÉ ļīĆĒĢ£ ļČĆļŗ┤ņØ┤ ņ׳ļŖö ĒÖśņ×ÉļōżņŚÉĻ▓īļÅä ņĀüņÜ®ĒĢĀ ņłś ņ׳ļŗżļŖö ņןņĀÉņØ┤ ļÉĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ Ļ▓░ņåÉļČĆņØś ĒÅēĻĘĀ Ēü¼ĻĖ░ļŖö 5.5(4.0~6.5 cm)├Ś4.1 cm(3.0~5.0 cm)ņśĆĻ│Ā, Ēö╝ĒīÉņØś ĒÅēĻĘĀ Ēü¼ĻĖ░ļŖö 5.2(4.0~6.0 cm)├Ś3.4 cm(3.0~4.5 cm)ļĪ£ Ļ│╝ĻĄÉņĀĢ ņŚåņØ┤ Ēö╝ĒīÉņØś Ēü¼ĻĖ░ļź╝ ļÅäņĢłĒĢśņśĆļŗż. ĻĘ╝ļ¦ē ņ£Āļ”¼ Ēö╝ĒīÉņØä ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ ņןĻĖ░ņĀüņ£╝ļĪ£ Ēö╝ĒīÉņØś ĻĄ¼ņČĢņØ┤ ļ░£ņāØĒĢ©ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ×¼Ļ▒┤ ņŗ£ 20~30%Ļ░Ćļ¤ēņØś Ļ│╝ĻĄÉņĀĢņØ┤ ĒĢäņÜöĒĢ£ļŹ░[16,17], ĒśæļČĆ ņĀÉļ¦ē Ēö╝ĒīÉņØś Ļ▓ĮņÜ░ ņĀÉļ¦ēņØś ĒŖ╣ņä▒ņāü ņØ┤ņŗØ Ēøä ĻĄ¼ņČĢņØ┤ Ļ▒░ņØś ņāØĻĖ░ņ¦Ć ņĢŖĻ│Ā ņśżĒ׳ļĀż ĻĘĖ ļ®┤ņĀüņØ┤ ļŗżņåī ĒÖĢņןļÉśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░[18,19], ņäżņé¼ ĻĄ¼ņČĢņØ┤ ļ░£ņāØĒĢ£ļŗż ĒĢśļŹöļØ╝ļÅä ĒśæļČĆ ņĀÉļ¦ēņØś Ļ▓ĮņÜ░ ņĄ£ļīĆ 30%Ļ░Ćļ¤ē ļŖśņ¢┤ļéĀ ņłś ņ׳ļŖö ĒāäļĀźņä▒Ļ│╝ ņ£ĀņŚ░ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņ¢┤ļŖÉ ņĀĢļÅäņØś ĻĄ¼ņČĢņØĆ ņØ┤ļ¤¼ĒĢ£ ņĀÉļ¦ēņØś ĒāäļĀźņä▒ņ£╝ļĪ£ ļ│┤ņāüļÉĀ ņłś ņ׳ļŖö ņŚ¼ņ¦ĆĻ░Ć Ēü¼ļŗż[20]. ļśÉĒĢ£ ņØ┤ļ¤¼ĒĢ£ ņĀÉļ¦ēņØś ĒāäļĀźņä▒Ļ│╝ ņ£ĀņŚ░ņä▒ņØĆ ĒśĆņÖĆ Ļ░ÖņØ┤ ņĪ░ņØī ļ░Å ņŚ░ĒĢś ņ×æņÜ®ņŗ£ ņŚŁļÅÖņĀü ņøĆņ¦üņ×äņØä ĒĢäņÜöļĪ£ ĒĢśļŖö ĻĖ░Ļ┤ĆņŚÉ ņ׳ņ¢┤ ņłĀ Ēøä ĻĖ░ļŖźņØä ņĄ£ļīĆĒĢ£ ļ│┤ņĪ┤ĒĢśļŖö ļŹ░ Ēü░ ļÅäņøĆņØ┤ ļÉĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż[13].
ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ ĒĢ£Ļ░Ćņ¦Ć ņŻ╝ļ¬®ĒĢĀ ļ¦īĒĢ£ ņĀÉņØĆ ņłśņłĀ ņżæ ĒśłĻ┤ĆĻ▓ĮņØä ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗ĒĢ£ 3ņśł(20.0%)ņŚÉņä£ļÅä ļ¬©ļæÉ ĒŖ╣ļ│äĒĢ£ ļ¼ĖņĀ£ ņŚåņØ┤ Ēö╝ĒīÉņØ┤ ņל ņāØņĪ┤Ē¢łļŗżļŖö Ļ▓āņØ┤ļŗż. ņØ┤ļŖö Bozola Ēö╝ĒīÉņØś ņĢłņĀĢņä▒ņØä ļŗżņŗ£ ĒĢ£ļ▓ł ļ│┤ņŚ¼ ņŻ╝ļŖö ņóŗņØĆ ņśłļĪ£, ĒśæļČĆ ļÅÖļ¦źņØä ņ¦üņĀæ ņŗ£ņĢ╝ņŚÉņä£ ĒÖĢņØĖĒĢśņ¦Ć ņĢŖļŹöļØ╝ļÅä Ēæ£ņżĆĒÖöļÉ£ ņłśņłĀ ņłĀĻĖ░ņŚÉ ļö░ļØ╝ ĒĢ┤ļŗ╣ ĒśłĻ┤ĆņØ┤ ņĪ┤ņ×¼ĒĢśļŖö ņĪ░ņ¦üņØś ņĖĄ(tissue plane)ņØä ĒżĒĢ©ĒĢśņŚ¼ Ēö╝ĒīÉņØä Ļ▒░ņāüĒĢ£ļŗżļ®┤ Ēö╝ĒīÉņØś Ēśłļźśļź╝ ņĢłņĀäĒĢśĻ▓ī ļ│┤ņĪ┤ĒĢĀ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢśļŖö ņåīĻ▓¼ņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£ Ļ│ĀņŗØņĀüņØĖ Bozola Ēö╝ĒīÉņØś Ļ▓ĮņÜ░ Ēøäļ░®ņŚÉ ĻĖ░ņĀĆļź╝ ļæö ĻĄŁņåī ņČĢņä▒ Ēö╝ĒīÉņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ļÅäņä£ĒśĢ Ēö╝ĒīÉĻ│╝ļŖö ļŗ¼ļ”¼ ņĀäņ▓┤ ĒśæļČĆņÖĆ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ļŖö Ēøäļ░® ņĀÉļ¦ēņØ┤ ņĪ┤ņ×¼ĒĢśņŚ¼ ņČöĻ░ĆņĀüņØĖ Ēśłļźś Ļ│ĄĻĖēņŚÉ ļÅäņøĆņØ┤ ļÉśņŚłņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Ēö╝ĒīÉņØä Ļ▒░ņāüĒĢ£ Ēøä ļ░£ņāØĒĢśļŖö ĒśæļČĆņØś Ļ│ĄņŚ¼ļČĆ Ļ▓░ņåÉņØĆ ļīĆļČĆļČäņØś Ļ▓ĮņÜ░ ņØ╝ņ░© ļ┤ēĒĢ®ņØ┤ Ļ░ĆļŖźĒĢśņŚ¼ Ļ│ĄņŚ¼ļČĆ Ļ▓░ņåÉ ņŚŁņŗ£ ņ¢┤ļĀĄņ¦Ć ņĢŖĻ▓ī ĒĢ┤Ļ▓░ĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņØ┤ņÖĆ Ļ┤ĆļĀ©ļÉ£ ĒĢ®ļ│æņ”Ø ņŚŁņŗ£ Ļ▓ĮĒĢ£ Ļ░£ĻĄ¼ņןņĢĀ ņØ┤ņÖĖņŚÉļŖö ĒŖ╣ļ│äĒ׳ ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśļŗż. Bozola Ēö╝ĒīÉ Ēøä Ļ░£ĻĄ¼ņןņĢĀĻ░Ć ļ░£ņāØĒĢśļŖö ņøÉņØĖņØĆ Ēö╝ĒīÉņØä Ļ▒░ņāüĒĢ£ Ēøä Ļ│ĄņŚ¼ļČĆņŚÉ ļ░£ņāØĒĢśļŖö ĒśæļČĆ ļ░śĒØö ļĢīļ¼ĖņØĖļŹ░ ņØ┤Ļ▓āņØĆ Ļ│ĄņŚ¼ļČĆņØś Ļ▓░ņåÉ Ēü¼ĻĖ░ņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņ¢┤ Ēö╝ĒīÉņØś ĒÅŁņØ┤ 3.0~3.5 cm ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ļŖö ņØ╝ļ░śņĀüņ£╝ļĪ£ Ļ│ĄņŚ¼ļČĆņØś ņØ╝ņ░© ļ┤ēĒĢ®ņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļŗżļŻ¼ ņżæļō▒ļÅä Ļ▓░ņåÉņŚÉ ļīĆĒĢ£ ņ×¼Ļ▒┤ņØś Ļ▓ĮņÜ░ņŚÉ ņ׳ņ¢┤ņä£ļÅä ņØ┤ņŚÉ ļČĆĒĢ®ĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż[12,21].
ļ│Ė ņŚ░ĻĄ¼ņØś 15ļ¬ģ ņżæ 10ļ¬ģ(66.7%)ņŚÉņä£ļŖö Ēö╝ĒīÉĻ▓ĮņØ┤ ņ╣śņĢäņŚÉ ņö╣Ē׳Ļ▒░ļéś ļ│┤ņ▓Ā ņé¼ņÜ®ņŚÉ ņןņĢĀĻ░Ć ļÉśņ¢┤ ņłśņłĀ 2~3ņŻ╝ Ēøä ņČöĻ░ĆņĀüņØĖ Ēö╝ĒīÉĻ▓Į ņĀłļŗ©ņØ┤ ĒĢäņÜöĒĢśņśĆļŗż. Bozola Ēö╝ĒīÉņØś Ēö╝ĒīÉĻ▓Į ņĀłļŗ©ņØĆ ļīĆļČĆļČäņØś Ļ▓ĮņÜ░ņŚÉ ņ׳ņ¢┤ ĻĄŁņåīļ¦łņĘ©ĒĢśņŚÉ 10ļČä ņØ┤ļé┤ļĪ£ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ņ£╝ļéś, ĒåĄņ”ØņŚÉ ļ»╝Ļ░ÉĒĢśĻ▒░ļéś ņČöĻ░ĆņĀüņØĖ Ēö╝ĒīÉņØś ņåÉņ¦łņØ┤ ĒĢäņÜöĒĢ£ ņØ╝ļČĆ ĒÖśņ×ÉņŚÉņä£ļŖö ņĀäņŗĀļ¦łņĘ©Ļ░Ć ĒĢäņÜöĒĢśĻĖ░ļÅä ĒĢśļŗż. ņØ┤ņ▓śļ¤╝ ņĀÉļ¦ē Ēö╝ĒīÉĻ▓ĮņØś ņĪ┤ņ×¼ļŖö ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ ņĢłņĀĢņĀüņØĖ Ēśłļźś Ļ│ĄĻĖēņŚÉ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳Ļ▓Āņ£╝ļéś, Ēö╝ĒīÉĻ▓Į ņĀłļŗ©ņØ┤ ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ ĻĘĖņŚÉ ļö░ļźĖ ĒÖśņ×ÉņØś ļČłĒÄĖĻ░É, ņ×¼ņ×ģņøÉ, ĻĘĖļ”¼Ļ│Ā ņØ┤ņ░© ņłśņłĀņŚÉ ļö░ļź┤ļŖö ņČöĻ░ĆņĀüņØĖ ļ╣äņÜ® ļō▒ņØĆ Bozola Ēö╝ĒīÉņØś ļŗ©ņĀÉ ņżæ ĒĢśļéśļĪ£ ņāØĻ░üļÉ£ļŗż. ļśÉĒĢ£ Bozola Ēö╝ĒīÉņØĆ Ļ▒░ņāü Ļ░ĆļŖźĒĢ£ ņĄ£ļīĆ Ēü¼ĻĖ░Ļ░Ć ņĢĮ 7├Ś5 cm ņĀĢļÅäļĪ£ ņĀ£ĒĢ£ļÉśņ¢┤ ņ׳ņ¢┤ Ļ▓░ņåÉņØś Ēü¼ĻĖ░Ļ░Ć Ēü░ Ļ▓ĮņÜ░ņŚÉļŖö ņ×¼Ļ▒┤ņØä ņ£äĒĢ£ ņČ®ļČäĒĢ£ ļČĆĒö╝ļź╝ ņĀ£Ļ│ĄĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļ®░, Ēö╝ĒīÉņØś ĒÜīņĀäņĀÉ(pivot point)ņØ┤ Ēøäļ░®ņŚÉ ņ׳ņ¢┤ ĒśĆņØś ņĀäļ░®ļČĆĻ╣īņ¦Ć ļÅäļŗ¼ĒĢśĻĖ░ņŚÉļŖö ņ¦¦ļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż[10,22]. ļö░ļØ╝ņä£ ņØ╝ļ░śņĀüņ£╝ļĪ£ ĒśĆņØś ņĀłļ░ś ņØ┤ņāüņØ┤ ņĀ£Ļ▒░ļÉśņ¢┤ Ļ▓░ņåÉ Ēü¼ĻĖ░Ļ░Ć ņżæļō▒ļÅä ņØ┤ņāüņ£╝ļĪ£ Ēü░ Ļ▓ĮņÜ░ļéś ĒśĆņØś ņĀäļ░®ļČĆ ņ×¼Ļ▒┤ņØ┤ ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ ļō▒ņŚÉ ņ׳ņ¢┤ņä£ļŖö, ņ£Āļ”¼ Ēö╝ĒīÉ ļō▒ņØś ļŗżļźĖ ņ×¼Ļ▒┤ ļ░®ļ▓ĢņØ┤ ņÜ░ņäĀ Ļ│ĀļĀżļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ņ░ĖĻ│ĀļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĻĄŁņåīņĀüņ£╝ļĪ£ ļŗżņåī ņ¦äĒ¢ēļÉśņŚłļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŖö T3 ļ│æĻĖ░ļź╝ Ļ░¢ļŖö ĒÖśņ×ÉļÅä 3ļ¬ģņØ┤ ĒżĒĢ©ļÉśņŚłļŖöļŹ░, ņØ┤ļōżņØĆ ņóģņ¢æ ļ│æĻĖ░Ļ░Ć T3 ņØ┤ĻĖ░ļŖö ĒĢśņśĆņ¦Ćļ¦ī ņóģņ¢æ ņןņČĢņØś Ēü¼ĻĖ░Ļ░Ć 4.1~4.5 cmņØĖ ņ┤łĻĖ░ T3 ĒÖśņ×ÉļōżļĪ£ ļ¬©ļæÉ ĒśĆ ļ░śņĀłņĀ£ņłĀ(hemiglossectomy)ņØ┤ ņŗ£Ē¢ēļÉśņŚłņ£╝ļ®░, ņłĀ Ēøä Ļ▓░ņåÉ ļČĆņ£äņØś Ēü¼ĻĖ░Ļ░Ć 6.5~7 cm ļé┤ņÖĖņśĆĻĖ░ ļĢīļ¼ĖņŚÉ Bozola Ēö╝ĒīÉņ£╝ļĪ£ļÅä ņ×¼Ļ▒┤ņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓ĮņÜ░ņśĆļŗż. ĒĢśņ¦Ćļ¦ī ĒśĆ ļ░śņĀłņĀ£ņłĀņØ┤ļØ╝ ĒĢśļŹöļØ╝ļÅä Ļ▓░ņåÉ ļČĆņ£äņØś Ēü¼ĻĖ░Ļ░Ć 7 cmļ│┤ļŗż Ēü░ Ļ▓ĮņÜ░ļéś ņĢäņĀä ņĀłņĀ£ņłĀ(near total glossectomy)Ļ│╝ Ļ░ÖņØ┤ ļ│┤ļŗż ļäōņØĆ ļ▓öņ£äņØś ņłśņłĀņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ä Ļ▓ĮņÜ░ņŚÉļŖö Bozola Ēö╝ĒīÉņ£╝ļĪ£ļŖö ņČ®ļČäĒĢ£ ļČĆĒö╝ļź╝ ņĀ£Ļ│ĄĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļ®░, ļö░ļØ╝ņä£ ņ£Āļ”¼ Ēö╝ĒīÉņØä ņé¼ņÜ®ĒĢśļŖö Ļ▓āņØ┤ ļ│┤ļŗż ņĀüņĀłĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ņØ┤ļ▓ł ņŚ░ĻĄ¼ņØś Ļ░Ćņן Ēü░ ņĀ£ĒĢ£ņĀÉņØĆ ļīĆņāü ĒÖśņ×ÉĻ░Ć 15ļ¬ģņ£╝ļĪ£ ņĀüņ£╝ļ®░, ļīĆņāü ĒÖśņ×ÉĻĄ░ņØä ņØ╝ņ░© ļ┤ēĒĢ®ļ▓ĢņØ┤ļéś ņ£Āļ”¼ Ēö╝ĒīÉņłĀĻ│╝ Ļ░ÖņØĆ ļŗżļźĖ ņ×¼Ļ▒┤ ļ░®ļ▓ĢĻ│╝ ņ¦üņĀæ ļ╣äĻĄÉ ļČäņäØĒĢśņ¦Ć ļ¬╗Ē¢łļŗżļŖö ņĀÉņØ┤ļŗż. ņ£Āļ”¼ Ēö╝ĒīÉņØĆ Ēæ£ļ®┤ņĀüņØ┤ ļäōņ£╝ļ®┤ņä£ ņ¢ćĻ│Ā ņ£ĀņŚ░ĒĢ┤ ļŗżņ¢æĒĢ£ ļ¬©ņ¢æĻ│╝ ĒśĢĒā£ļź╝ ņ×¼Ļ▒┤ĒĢĀ ņłś ņ׳ļŗżļŖö ņĀÉņŚÉņä£ Ēü░ ļ▓öņ£äņØś ĻĄ¼Ļ░Ģ Ļ▓░ņåÉ ļČĆņ£äņŚÉ ņ׳ņ¢┤ Ļ░Ćņן ņóŗņØĆ ļ░®ļ▓Ģ ņżæ ĒĢśļéśņØ┤ļŗż[23]. ĒĢśņ¦Ćļ¦ī Ēö╝ĒīÉņØś ļČĆĒö╝Ļ░Ć Ēü¼Ļ│Ā ĒāäļĀźņä▒ņØ┤ ņŚåņ¢┤ ņØ┤ņŗØ Ēøä ļé©ņĢä ņ׳ļŖö ĻĄ¼Ļ░ĢņäżņØś ņøĆņ¦üņ×äņØä ļ░®ĒĢ┤ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ▓░ņåÉņØś Ēü¼ĻĖ░Ļ░Ć Ēü¼ņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉ ņ׳ņ¢┤ņä£ļŖö ņśżĒ׳ļĀż ņłĀ Ēøä ĻĖ░ļŖźņØä ņĀĆĒĢ┤ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņŗżņĀ£ T3 ĻĄ¼Ļ░ĢņäżņĢöņØ┤ļéś ĒśĆ ļ░śņĀłņĀ£ņłĀņØ┤ ņŗ£Ē¢ēļÉ£ Ļ▓ĮņÜ░ļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņ£Āļ”¼ Ēö╝ĒīÉņŚÉ ļ╣äĒĢ┤ ņØ╝ņ░© ļ┤ēĒĢ®ņØ┤ ļ│┤ļŗż ļéśņØĆ ņĪ░ņØīĻ│╝ ņŚ░ĒĢś ĻĖ░ļŖźņØä ļ│┤ņØ┤ĻĖ░ļÅä ĒĢśņśĆļŗż[24,25]. ĒĢśņ¦Ćļ¦ī ņØ╝ņ░© ļ┤ēĒĢ®ņØś Ļ▓ĮņÜ░ ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĄ¼Ļ░ĢņäżņØś 1/4~1/3Ļ░Ćļ¤ēņØś Ļ▓░ņåÉņŚÉņä£ļŖö ņĀüņÜ®ļÉĀ ņłś ņ׳ņ£╝ļéś, Ļ▓░ņåÉ ļČĆņ£äĻ░Ć ĻĘĖļ│┤ļŗż Ēü░ Ļ▓ĮņÜ░ņŚÉļŖö ņśżĒ׳ļĀż ļ░śĒØöņŚÉ ņØśĒĢ£ ĻĄ¼ņČĢ ļ░£ņāØ ļ░Å ņŚ░ĒĢś ņ×æņÜ®ņŚÉ ĒĢäņÜöĒĢ£ ņČ®ļČäĒĢ£ ļČĆĒö╝ ļČĆņĪ▒ņ£╝ļĪ£ ļ¦īņĪ▒ņŖżļ¤¼ņÜ┤ Ļ▓░Ļ│╝ļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņŚåļŗż[25]. Bozola Ēö╝ĒīÉņØś Ļ▓ĮņÜ░ ņØ┤ņÖĆ Ļ░ÖņØ┤ ņØ╝ņ░© ļ┤ēĒĢ®ņØä ĒĢśĻĖ░ņŚÉļŖö ļŗżņåī Ēü¼ĻĖ░Ļ░Ć Ēü░ ņżæļō▒ļÅä Ēü¼ĻĖ░ņØś ĻĄ¼Ļ░Ģ Ļ▓░ņåÉņŚÉ Ļ░Ćņן ņĀüĒĢ®ĒĢ£ Ēö╝ĒīÉņ£╝ļĪ£, ņ£Āļ”¼ Ēö╝ĒīÉĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ņä£ļŖö ĻĘĖ ņłĀĻĖ░ņØś Ļ░äļŗ©ĒĢ©Ļ│╝ ĻĘ╝ņĀÉļ¦ē Ēö╝ĒīÉņØ┤ Ļ░¢ļŖö ĒŖ╣ņ£ĀņØś ĒāäļĀźņä▒ņØ┤ ņØ┤ Ēö╝ĒīÉņØ┤ Ļ░¢ļŖö Ļ░Ćņן Ēü░ ņןņĀÉņØ╝ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. Ē¢źĒøä ņØ┤ņÖĆ Ļ░ÖņØ┤ ņØ╝ņ░© ļ┤ēĒĢ®ņØ┤ļéś ņ£Āļ”¼ Ēö╝ĒīÉ, ĻĘĖļ”¼Ļ│Ā Bozola Ēö╝ĒīÉ ļō▒ņØś ņןļŗ©ņĀÉņØä Ļ│ĀļĀżĒĢśņŚ¼ ņżæļō▒ļÅäņØś ĻĄ¼Ļ░Ģ Ļ▓░ņåÉņØä Ļ░¢ļŖö ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ Ļ░ü ļ░®ļ▓Ģļōż Ļ░äņØś ļ╣äĻĄÉ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņäżņĢö ĒÖśņ×ÉņŚÉņä£ Bozola Ēö╝ĒīÉņØä ņØ┤ņÜ®ĒĢ£ ņżæļō▒ļÅä ĻĄ¼Ļ░Ģ Ļ▓░ņåÉņØś ņ×¼Ļ▒┤ņØĆ ļ╣äĻĄÉņĀü Ļ░äļŗ©ĒĢśļ®┤ņä£ļÅä ņŗ¼Ļ░üĒĢ£ ļČĆņ×æņÜ® ņŚåņØ┤ ļåÆņØĆ ņä▒Ļ│ĄļźĀņØä Ļ░¢ļŖö ĒÜ©Ļ│╝ņĀüņØĖ ļ░®ļ▓Ģņ×äņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļ▓ł ņŚ░ĻĄ¼ļź╝ ļ░öĒāĢņ£╝ļĪ£ Bozola Ēö╝ĒīÉņØ┤ ļ»ĖņäĖĒśłĻ┤Ć ņłśņłĀņŚÉ ņØĄņłÖĒĢśņ¦Ć ņĢŖņØĆ ļ¦ÄņØĆ ļæÉĻ▓ĮļČĆ ņÖĖĻ│╝ņØśņŚÉĻ▓ī ĻĄ¼Ļ░Ģ ņ×¼Ļ▒┤ņØä ņ£äĒĢ£ ņóŗņØĆ ļ░®ļ▓Ģ ņżæ ĒĢśļéśļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ĻĖ░ļź╝ ĻĖ░ļīĆĒĢśļŖö ļ░öņØ┤ļŗż.