서 론
메니에르병(Me´nie`re’s disease, MD)은 갑작스러운 현훈 발작(sudden vertigo attack), 변동하는 감각신경성 난청(fluctuating sensorineural hearing loss)과 이명 및 이충만감을 특징으로 하는 질환이다.
메니에르병은 19세기 말 Prosper Me´nie`re (1799-1862)에 의해 처음 발견되기는 하였으나, 당시에는 정확한 병리학적 소견이 제시되지 못했다[1]. 이후 1938년이 되어서야 Yamakawa와 Hallpike group이 거의 동시에 환자들의 측두골 표본을 연구하여 메니에르병의 병태생리학적 근거를 제시했다. 그들은 생전에 메니에르병 증상을 보이는 환자들의 측두골에서 발견된 내림프 수종(endolymphatic hydrops, EH)에 대해 기술하였고, 이러한 발견은 여러 다른 조직병리학적 연구들에 의해서 추가적으로 확인되었다. 오늘날 내림프 수종은 메니에르병의 가장 중요한 조직병리학적 양상으로서 보편적으로 받아들여지고 있다[2,3].
메니에르병의 진단기준은 그동안 몇 번의 변화를 거쳐왔다. 1972년 The American Academy of Otolaryngology 산하 ‘A hearing balance subcommittee’에서 메니에르병의 정의와 진단기준을 정하였으며, 이후 ‘American Association of Otolaryngology-Head and Neck Surgery (AAO-HNS)’에서 1985년과 1995년에 진단기준을 변경하였다[4]. 한동안 1995년 AAO-HNS 기준이 보편적으로 받아들여졌으나 확실한 메니에르병(certain MD)은 생전에 진단이 불가능하였고 가능성이 있는 메니에르병(possible MD)은 진단적 가치가 낮다고 판단되었다. 따라서 2015년에 Ba´ra´ny Society에서 “certain,” “possible” 메니에르병을 삭제한 새로운 진단 기준을 발표하여 널리 사용 중이다(Table 1) [5].
2015년 이후 진단기준이 단순화되긴 하였지만, 메니에르병의 진단이 쉬워진 것은 아니다. 현재 진단 기준은 순음청력 검사를 제외하고는 환자의 증상 및 병력을 비롯한 주관적 증상에만 의존적이며, 기타 전정계 질환이 여전히 배제되어야 한다. 순음청력검사를 제외하면 전기와우도검사(electrocochleography, ECoG), 비디오 두부충동검사(video head impulse test, vHIT), 전정유발근전위검사(vestibular evoked myogenic potential test, VEMP), 온도안진검사(caloric test) 등이 진단을 위한 부가적인 검사로 널리 사용되어 왔다. 특히 ECoG는 30년 이상 메니에르병 진단에 대한 부가적인 검사로 가장 널리 이용되어 왔다[3]. 하지만, 이 또한 내림프 공간(endolymphatic space)과 내림프 수종을 직접적으로 시각화하는 것은 불가능하다는 명확한 한계점을 가져, ECoG의 진단적 가치에 대해서는 여러 보고와 문헌에서 여전히 논란이 있다[6]. VEMP와 온도안진 검사, vHIT 또한 내림프 수종의 유무를 정확히 파악하거나 메니에르병의 진단 기준에 포함되기에는 검사의 민감도나 특이도가 매우 부족하다[7,8].
2000년대 중반 이래로 MRI를 이용한 영상 기술이 발달하면서 인간의 내림프 수종을 확인하기 위한 다양한 시도가 이어져 왔다. 2004년 Duan 등[9]은 최초로 살아있는 기니피그로 4.7T MRI 영상을 촬영하여 내이 기관의 내림프 수종을 성공적으로 확인하였다. 일본 나고야 대학의 Nakashima 등[10]은 메니에르병 환자에게 고실내(intratympanic) 그리고 정맥내(intravenous, IV) 조영제 주입 후 3T MRI를 이용하여 내림프 수종을 확인하였다. 그 이후 MRI를 이용하여 내림프 수종을 확인하고자 하는 노력이 전세계적으로 증가하였다. 특히 정맥내 가돌리늄(IV-gadolinium) 조영 증강 내이 MRI는 고실내 조영제 주입법과 비교하여 몇 가지 장점을 가진다[11,12]. 정맥내 조영증강법은 고실내 조영제 주입법에 비하여 덜 침습적이며, 고실내 조영제 주입법에서는 조영제 주입 후 촬영까지 24시간 정도가 필요함에 비해 정맥내 조영증강법은 조영제 주입 후 4시간 정도가 필요하여 시간적 측면에서 훨씬 더 효율적이다. 게다가 고실내 조영제 주입법은 양측을 동시에 평가하기 위하여 양측 귀 주입이 필요하지만, 정맥내 조영증강법은 1회의 정맥내 주입을 통해 동시에 양측을 평가할 수 있다[13]. 일부 연구에서는 메니에르병 환자의 증상과 MRI상 내림프 수종의 중증도 간 연관성을 보고해왔으며, 이러한 결과는 이전에 사용되었던 청각-전정계 검사와 좋은 상관관계를 보여줌으로써 정맥내 가돌리늄 조영증강 내이 MRI가 메니에르병 진단에 유용하다는 것을 증명하였다[14].
저자들은 비록 실제 진료 현장에서 아직 메니에르병의 진단기준에 포함되지는 않았으나, 내이 MRI가 내림프 수종이 의심되는 환자들에게 임상적으로 현재 어떻게 활용되고 있는지 소개하고자 한다.
본 론
내이 MRI의 적응증
내림프 수종의 확인이 가능한 내이 MRI는 메니에르병이 의심되는 환자는 물론, 내림프 수종과 관련있을 것으로 추정되는 다양한 질환에도 촬영해 볼 수 있다. 특히, 증상이나 기존 다른 검사 결과들이 애매하여 내림프 수종을 배제할 때에도 유용하며 조영제의 사용으로 청신경초종을 비롯한 종양성 병변이나 기타 뇌병변의 감별진단에도 활용이 가능하다.
내림프 수종과 관련이 있을 수 있는 돌발성 난청(idiopathic sudden sensorineural hearing loss)의 경우 저주파에 국한된 경우가 전체 환자의 23%에나 이르며, 이들은 내림프 수종의 유무를 MRI로 확인하는 것이 예후나 치료효과 예측에 어느 정도 도움이 될 수 있다. 이외에도 반복되는 어지러움이 있으나 온도안진검사나 vHIT, 비디오안진검사 등에서 특별한 이상소견이 없고, 청력 관련 증상이 없는 경우로 vestibular MD 등을 확인하는 데에도 내이 MRI는 유용하다[15].
이 외에도 내림프 수종을 배제해야 하거나 증상이 메니에르병과 유사하여 감별진단이 필요한 경우들이 있는데 Nakashima 등[16]은 다음과 같은 경우를 예시로 제시하였다; large vestibular aqueduct syndrom, superior canal dehisence syndrome, low cerebrospinal fluid pressure syndrome, perilymphatic fistula. 이들 질환의 감별진단에 있어서도 내이 MRI는 기존의 다른 검사보다 객관적으로 내림프 수종을 평가할 수 있기 때문에 훨씬 유리하다.
내이 MRI의 시퀀스 및 분석 프로토콜
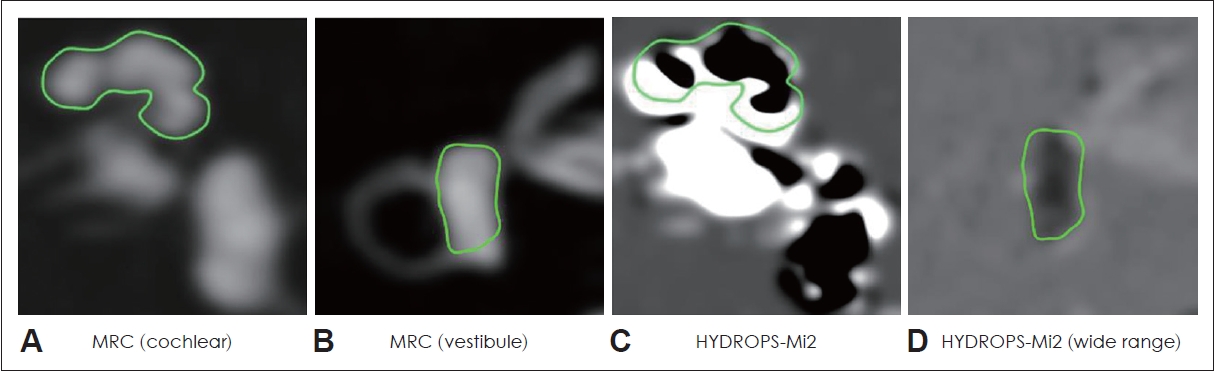
2000년대 중반 이래로 3T MRI를 이용한 three-dimensional fluid-attenuated inversion recovery (3D-FLAIR) 시퀀스(sequence)는 메니에르병에서 내림프 수종을 확인하기 위하여 이용되어 왔다[10]. 최근에는 3D-FLAIR 시퀀스와 inversion recovery turbo spin echo with real reconstruction (3D real-IR) 시퀀스가 조영 증강된 외림프(perilymph)와 조영증강 되지 않는 내림프(endolymph) 간의 신호 차이(signal differences)를 식별하기 위한 MRI 프로토콜로서 가장 많이 이용된다[17]. 3D real-IR 시퀀스의 주요 장점은 주위 뼈(bone)를 중간(grey) 신호로 나타냄으로써, 외림프, 내림프, 인접한 뼈가 하나의 영상에서 구분될 수 있다는 것이다[18]. MRI 영상은 신호를 최대화하기 위하여 32개 이상 채널(channel)의 다중 수신 채널(multiple receiver channel)과 전용 헤드 코일(dedicated head coil)이 포함된 3T MRI에서 최적으로 획득되었다. 기본 MRI 스캔 시퀀스는 다음과 같다: 1) 총 내림프액, 외림프액의 해부학적 참고치(anatomical reference)를 위한 heavily T2-weighted (hT2W) MR cisternography (MRC), 2) 외림프 공간을 시각화하기 위한 2250 ms 역전 시간(inversion time)의 hT2W-3D-FLAIR (positive perilymph image, PPI), 3) 내림프 공간을 평가하기 위한 2050 ms 역전 시간의 hT2W-3D-IR (positive endolymph image, PEI). 특히 PEI 시퀀스는 역전 시간이 2050 ms라는 점을 제외하면 PPI의 시퀀스와 동일하다. 비교를 용이하게 하기 위하여 MRC, PPI, PEI는 동일한 field of view, 매트릭스 크기(matrix size), 슬라이스 두께(slice thickness)를 적용하여야 한다. 다음 단계는 스캐너 콘솔(scanner console)에 HYDROPS (HYbriD of Reversed image Of Positive endolymph signal and native image of positive perilymph Signal)를 생성하기 위하여 PPI 이미지로부터 PEI 이미지를 제하는 과정이다. 이 과정을 마치면 내림프 공간의 확장 정도를 시각적으로 분석하는 것이 가능하다.
얻어진 영상에서 내림프내 공간의 수종 크기는 와우나 전정의 전체 크기를 나눔으로써 그 비율을 정량화시킬 수 있다. 다만, 임상적으로 모든 영상을 계산하여 정량화시키는 데에는 상당한 시간과 노력이 소요된다. 따라서 임상적으로 빠르고 정확한 판독과 진단을 위하여 여러 등급 체계가 소개되어 왔는데, Nakashima 등[19]에 의해 2009년에 발표된 다음과 같은 등급체계가 현재 가장 널리 사용되고 있다. 전정에서의 면적 비율(area ratio)은 영상에서 측정된 전정의 내림프 공간의 면적과 유액 공간(내림프 공간과 외림프 공간의 합)의 면적에서 내림프 공간의 면적이 차지하는 비율로 정의하고, 면적 비율이 33.3% 이하인 경우를 내림프 수종 등급(grade of hydrops) ‘none (없음)’, 면적 비율 33.3% 초과, 50% 이하인 경우를 ‘mild (경미함)’, 면적 비율 50% 초과인 경우를 ‘significant (유의미함)’로 정의한다. 와우의 경우에는 ‘none’, ‘mild’, ‘significant’로 구분하며, 이때, ‘none’의 경우 영상에서 와우의 라이스너 막(Reissner’s membrane)의 전위가 확인되지 않으며, ‘mild’의 경우 라이스너 막의 전위가 확인되나 전정계(scala vestibuli) 면적이 와우관(cochlear duct) 면적보다 같거나 크고, ‘significant’의 경우 라이스너 막의 전위가 확인되며 와우관 면적이 전정계 면적을 초과하게 된다. 다만 이러한 등급체계의 적용은 숙달된 영상의학과나 이비인후과 전문의에 의해서만 가능하며, 획득된 영상 품질이나 환자에 따라 객관적으로 정확히 등급을 분간하기에 애매할 수도 있는 것이 큰 단점이다.
따라서 와우와 전정내의 내림프 수종의 비(ratio)를 보다 정확히 계산하기 위하여, 대조를 증가시키기 위한 기술 또한 발명되었다. HYDROPS 영상에서 대조 대 잡음 비(contrast-to-noise ratio)를 증가시키기 위해, HYDROPS 영상과 MRC 영상을 곱함(multiplication)으로써 DICOM viewer에서 HYDROPS-Mi2 영상을 생성할 수 있다(Fig. 1). 추가적으로, 모든 와우와 전정기관의 외부 경계가 사람에 의해 윤곽(contour)을 따라 수동으로 그려진 후 비율을 비로소 정확히 계산할 수 있게 된다(Fig. 2). 하지만 이러한 수동적이고 복잡한 과정들은 앞서 언급한 바와 같이 임상 현장에서는 매우 시간 소모적이며, 번거롭고, 비효율적이다. 따라서 자동화된 분석 시스템이 도입된다면 기존 등급 체계보다는 훨씬 더 구체적이고 정확하며, 동시에 현실에서 시간 소모적이고 복잡한 과정없이 정확하게 내림프 수종 비(EH ratios)를 계산하기 위한 훌륭한 옵션이 될 수 있다.
딥러닝을 활용한 내림프 수종 자동화 분석 시스템의 활용
내이 MRI를 이용하여 내림프 수종과 연관된 내이 질환들의 감별진단에 큰 도움을 받을 수 있다. 다만 이를 위해 내림프 수종 비를 정확하고 일관적으로 계산하는 것이 필수적이나 아직은 전문의에 의한 수동적인 계산이 필요하기에 내림프 수종 비를 정확하게 계산하는 것은 시간 소모적이라는 단점이 늘 있어 왔다. 이에 현실적으로 정확하게 내림프 수종비를 계산하기 위한 자동화된 분석 시스템은 좋은 선택지가 될 수 있다.
자동화 시스템의 도입을 위해 이전 연구들에서는 내이 기관의 자동 분할(automatic segmentation)을 적용하였다. 예를 들어, 한 연구에서는 임계값 기술(thresholding techniques)과 수동 분할 방식을 결합한, 반자동 CT 영상 분할에 대하여 기술하였지만, 이는 여전히 분할 과정을 위해 전문가에 의한 세부 조정이 필요하였다[20]. 또다른 연구에서는 3차원 재건 영상을 위한 Niblack 분할 알고리즘과 랜덤 포레스트 분류기(random forest classifier)를 적용하여 내림프 공간과 총 림프액 공간을 측정하였지만 이 역시 완전자동화 시스템이라고 보기에는 어렵다[21]. 이에 개별 기관(와우, 전정기관)의 의미적 분할(semantic segmentation)을 위한 더욱 자동화된 딥러닝 알고리즘(deep learning algorithms)의 필요성이 대두되었고 본원에서는 해당 시스템을 개발하여 적용하고자 하였다.
이를 위해서 가장 단순한 접근법은 완전히 연결된 인공 신경망(artificial neural network)을 이용하는 것일 수 있지만, 이는 모든 픽셀이 모든 뉴런(neuron)에 연결되어야 하기 때문에 상당한 노력과 고성능의 시스템이 필요하다. 이에 반해 합성곱 신경망(convolutional neural network, CNN)은 하위 레이어(lower layer)의 근접도(proximity)에 따른 연결(connections)과 여과(filtering)를 통해 최소한의 노력으로 이미지를 분석하고 다루는 것이 가능하다[22].
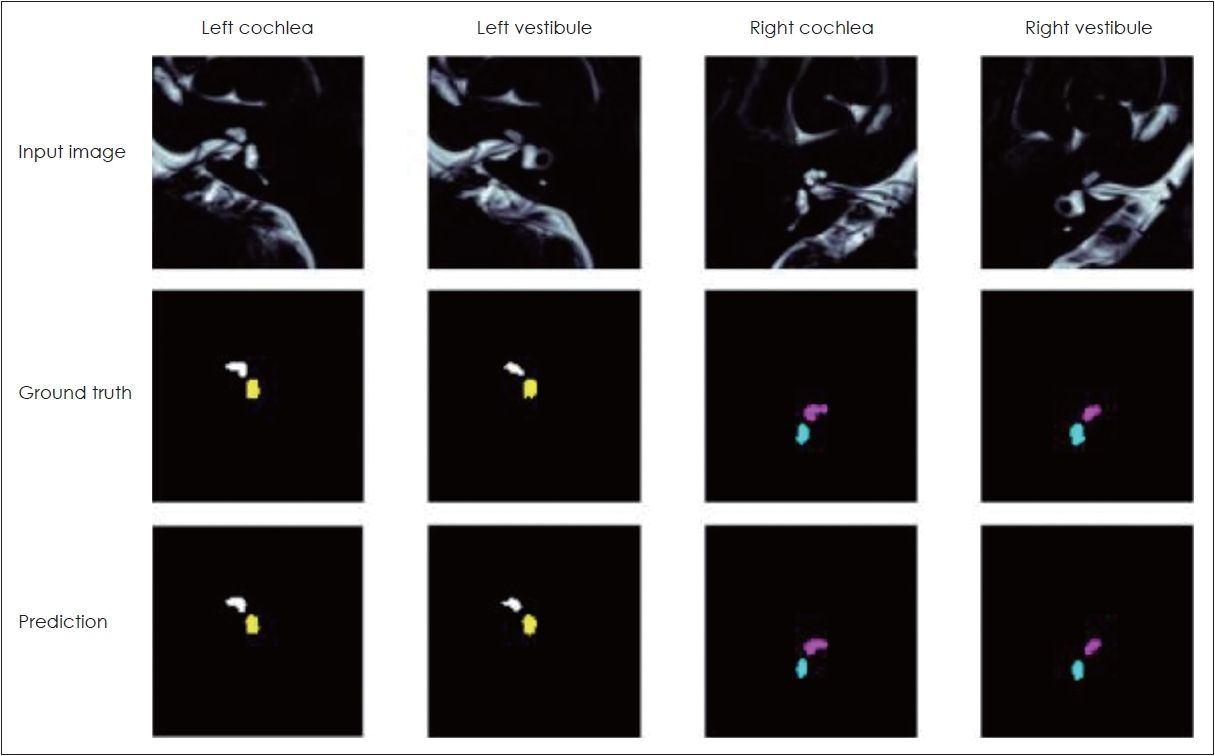
CNN을 이용하여 정확하게 내림프 수종을 측정하기 위하여 다음의 과정들이 필요하다: 1) 훈련을 위한 자료의 준비(data prepration); 2) 훈련된 영상에 기반한 내이 기관(와우, 전정기관)의 정확한 분할(accurate segmentation); 3) 분할된 영역에서 내림프 수종 비의 정확하고 자동적인 계산(accurate and automatic calculation of the EH ratio)이 바로 그 것이다(Fig. 3).
이러한 CNN을 활용한 내림프 수종 비율의 정확한 계산은 실제 임상의에 의한 계산과 비교할 수 없을 정도로 빠르며 간편하다. 결과값은 임상의에 의해 수행된 수동적인 분석의 결과값과 유사하다(Fig. 4). 실제 환자 데이터에서 CNN을 활용한 분석과 숙련된 영상의학과 뇌신경 판독 전문의가 분석한 평균 급내상관계수(interclass correlation coefficient, ICC) 값은 0.971이었으며, 전정기관 영상의 평균 ICC 값은 0.980으로 와우 영상의 평균 ICC 값 0.952보다 높았다. 분석에 소요된 시간의 경우 숙련된 전문의는 처리된 이미지를 통해 내림프 수종 비를 계산하는 데에 10분가량 소요된 반면, AI의 경우 판독에서 분석까지 단 0.168초 소요되었다.
이러한 알고리즘과 체계를 이용하여, 우리는 내림프 수종비를 정확하고 빠르게 예측할 수 있다. MRI를 이용하여 내림프 수종을 분석함으로써, 유사한 증상을 가지는 다른 질환들로부터 메니에르병을 구분하여 더욱 정확하게 메니에르병에 대한 진단이 이루어질 수 있다. 게다가 내이 MRI를 이용한 내림프 수종 비의 자동적인 정량적 분석은 질병의 단계와 예후를 평가하는 데 적용될 수 있으며, 더 나아가 내림프 수종과 연관될 것으로 의심되는 수많은 증상과 질환에 대한 진단을 더욱 쉽게 만들 수 있다. 현재까지는 전체 MRI 영상으로부터 대표적인 섹션만 추출되어 내림프 수종 비가 계산되고 있지만, 추후 내이 기관내의 전체 내림프 수종의 부피가 빠르게 계산될 수 있다면 더욱 효과적일 것이다.
내이 MRI 결과의 임상적 해석
내이 MRI를 통해 내림프 수종이 차지하는 비율은 비교적 객관적으로 정량적 분석이 가능하다. 이는 환자 증상이나 임상적 특징이 내림프 수종과 관련이 있을 것으로 판단되나 다른 검사들(예: 순음청력검사, 온도안진검사, ECoG, vHIT 등)이 이를 제대로 설명하지 못할 때 진단 및 예후 예측에 참고할 수 있어 매우 유용하다. Pe´rez-Ferna´ndez 등[23]은 일측성 메니에르병으로 진단을 받은 환자들을 대상으로, 온도안진 검사와 vHIT 모두 정상인 군과, 온도안진검사와 vHIT 중 온도안진검사만 비정상 결과를 보인 군을 비교하였다. 결과적으로, 온도안진검사만 비정상 결과를 보인 군에서는 내이 MRI를 통해 측정한 전정 내림프 수종의 정도가 유의하게 높았음을 주장하였는데, 이처럼 검사들 간의 불일치가 나타나는 경우 내이 MRI를 통해 획득한 정보를 검사결과 해석 및 진단에 참고할 수 있다. 다만, 획득된 이미지의 품질이나 환자 개인별로 차이가 있을 수 있는 혈액내이장벽(blood labyrinthine barrier) 투과도, 라이스너 막(Reissner’s membrane)의 손상이나 투과성의 변화에 따라 내림프 수종의 양이나 상태를 정확히 파악하기 어려울 수 있어 해석에 주의를 요한다.
또한, 세계적으로 여러 연구들이 진행되고 있으나, 메니에르병에서 내이 MRI 사용 가능성에 대해 아직 유효성이 확실히 입증되지는 않았다. 내이 MRI를 통해 내림프 공간을 확인하고 내림프 수종 비를 계산할 수 있지만, 프로토콜 또는 분석 방법 또한 연구자들 간 차이를 보인다. 일부 연구에서는 메니에르병 환자들에서 치료를 통해 증상이 개선되었으나, 치료 후의 MRI상에서 내림프 수종의 패턴은 변화가 없거나 오히려 증가한 경우가 있어서 메니에르병에서 내림프 수종의 해석과 발병기전에 대한 의문도 증폭되고 있다[24,25].
따라서 아직까지는 진단 및 예후 예측에 있어서 MRI로 활용된 내림프 수종의 양이 절대적인 기준이나 참고사항이 되어서는 안되며, 임상증상과 과거력, 기타 청력검사를 포함한 다양한 전정기능검사들을 충분히 참고하여 종합적으로 결론을 내리는게 옳다. 하지만 실제 증상과 다른 검사들 간의 이질성이 보이거나, 해석 및 진단이 애매한 경우에 객관적 지표인 내림프 수종의 확인 및 그 정도의 분석은 분명 임상에 큰 도움이 될 것이며, 향후 지속적인 연구 및 개선을 통해 관련 질환들의 병태생리학적인 현상을 설명하거나, 기전을 밝히는 데에도 매우 큰 역할을 할 것이라 기대된다.
결 론
메니에르병은 진단 및 예후 예측이 어려운 질환 중의 하나로 치료 또한 쉽지 않다. 하지만 최근 MRI 장비의 발전과 여러 연구자들의 노력으로 내이 MRI 프로토콜이 발전되어 내림프 수종을 직접적으로 시각화 함으로써 메니에르병의 가장 중요한 조직병리학적 양상인 내림프 수종에 대한 임상적 접근이 용이해지고 있다. 딥러닝을 활용한 내림프 수종 자동화 분석 시스템을 통해 내이 MRI를 이용한 내림프 수종의 분석을 더욱 정확하고 효과적으로 시행하고자 하는 연구가 진행되고 있으며, 이는 추후 메니에르병을 포함하여 내림프 수종과 연관된 다양한 질환의 진단과 예후 예측에 크게 기여할 수 있을 것으로 기대된다. 우리는 현 시점에서 내이 MRI의 가능성 및 한계를 명확히 알고 임상적 활용성을 넓혀감과 동시에 많은 연구를 수행하여 향후 진단적 가치가 확립될 수 있도록 노력해야 할 것이다.