상경부 부위 융기피부섬유육종 환자 1예
A Case of Dermatofibrosarcoma Protuberans on the Upper Neck
Article information
Trans Abstract
Dermatofibrosarcoma protuberans (DFSP) is a rare fibroblastic tumor that has a high local recurrence rate and low metastatic potential. Due to the small patient population of DFSP, there is no established protocol for its diagnosis and treatment, and prognosis has not been sufficiently studied. Therefore, DFSP is often initially misdiagnosed for a benign skin lesion, and various treatment methods have been used in reported previous DFSP cases. The authors also experienced a case of DFSP that had been misdiagnosed first as a subcutaneous benign tumor on the right upper neck; it was eventually removed by wide local excision. A year and 3 months have passed since the excision, and we hereby report the diagnosis, treatment process, and prognosis to contribute to establishing a treatment protocol.
서 론
융기피부섬유육종(dermatofibrosarcoma protuberans, DFSP)은 진피 섬유모세포에서 발생하는 드문 종양 중 하나로 1925년 Hoffmann에 의해 처음 명명되었다. DFSP는 전반적으로 예후가 좋고 전이는 드무나 국소 재발이 흔한 피부 악성종양이다[1].
임상 양상으로 초기에 DFSP로 진단되는 경우는 흔하지 않으며 국내 증례에서도 양성종양으로 오인된 경우가 대부분이다. 실례로, 켈로이드로 오인되었던 증례[2], 전두부 양성 피부 병변으로 오인하여 국소 스테로이드 치료를 받았던 증례[3], 요추부 피부 반점으로 오인하여 국소 스테로이드 치료를 받았던 증례[4] 등이 보고되었다. 따라서 DFSP를 정확하게 진단하거나 치료하고 예후를 예측하기에는 보고된 환자군이 충분하지 않아 정립된 것이 없는 실정이다.
본 저자 또한 상경부 피하 양성종양으로 의심되어 절제술을 시행하였으나 DFSP로 확인되어 광범위 절제를 하였던 환자 1예를 경험하였기에 DFSP의 진단 및 치료 과정 정립에 도움이 되고자 문헌 고찰과 함께 보고하고자 한다.
증 례
31세 특이 과거력이 없는 남자가 내원 1년 전부터 우연히 만져지고 서서히 커지는 우측 상경부 혹에 대하여 개인 병원에서 초음파를 시행하였고 피하 종괴가 확인되어 본과로 의뢰되었다. 초음파 소견으로는 4.4 cm 가량의 타원형 이종성 에코 실질을 가진 종괴로 주변과의 경계가 비교적 명확하였다(Fig. 1). 통증이나 압통 등의 자가 호소 증상은 없었고 신체 진찰상 우측 이하선 미부의 피하층에 4 cm 크기의 고무 같이 단단한 유동성 종괴가 촉지되었다. 종괴는 피부와의 유착이 관찰되었지만 피부 융기나 색의 변화는 보이지 않았다. 혈액검사에서는 질환을 의심할 만한 특이 소견은 없었다. 두경부 전산화단층촬영(CT) 결과 3.3 cm 크기의 경계가 명확하고 조영증강된 타원형 종괴가 우측 턱각 부위에서 확인되었고 진피, 피하층 침범 소견이 있었다(Fig. 2).

Head and neck ultrasonography. An approximately 4.4 cm-sized heterogenous echoic mass on right upper neck.

Head and neck CT. A 3.3×2.2 cm well circumscribed enhancing mass was found on right upper neck subcutaneous/skin layer (A, axial view; B, coronal view).
상기 소견으로 피부 양성종양을 고려하였고 치료로 완전 절제를 계획하였다. 피부 주름을 따라 절개 후 종양을 피막 외 박리하던 중 심부 경계로 진행할수록 주변 조직과의 유착이 심하였고 출혈 경향성이 높았으며 경계가 불분명하였다. 이에 악성 가능성이 높다고 판단하였고 동결절편 생검 후 악성이 확인될 경우 피부를 포함한 광범위 절제술을 고려하며 피막을 보존한 종괴 적출술을 시행하였다. 고무 양상의 종괴로 수술 중 시행한 동결절편 생검에서 방추 세포(spindle cell) 종양으로 확인되었으나 악성 여부는 확인되지 않았고 양성 종양 가능성을 배제할 수 없어 더 이상 수술을 진행하지 않고 추가 검사 후 재수술 가능성을 염두에 두며 수술을 마무리하였다.
조직 검사 결과상 H&E 염색에서 방추형 세포들이 나선형으로 뻗어나가는 스토리폼(storiform) 형태를 확인하였고 방추형 세포가 지방세포들 주변으로 침윤하여 벌집(honeycomb) 모양도 관찰되었다. 유사분열 지수는 13/10HPFs였고 면역조직화학 검사상 특징적으로 CD34에 양성인 반면, S-100, actin 등에서는 음성을 보여 DFSP로 최종 진단되었다(Fig. 3).
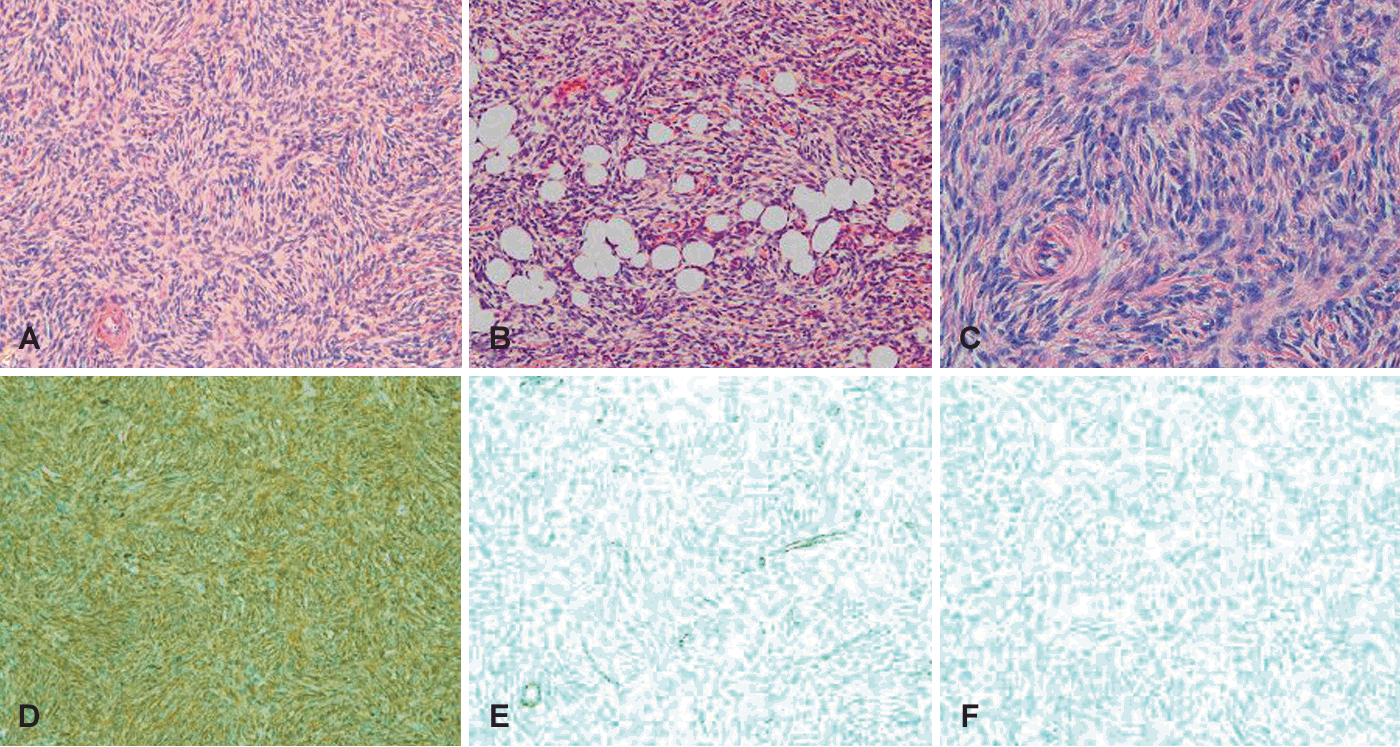
Pathologic findings. A: There are spindle cells in storiform pattern (hematoxylin and eosin [H&E], ×200). B: It shows honeycomb pattern (H&E, ×200). C: Tumor cells show elongated, mild hyperchromatic nuclei and small amount (H&E, ×400). D: Tumor cells show positive reaction in CD34 immunostain (CD34 immunostain, ×200). E: Tumor cells show negative reaction in actin immunostain (actin immunostain, ×200). F: Tumor cells show negative reaction in S-100 protein immunostain (S-100 protein immunostain, ×200).
DFSP는 국소 재발이 흔하고 전이는 드물지만, 간혹 주변 임파선이나 폐로 전이되는 증례가 있어 두경부 자기공명영상(MRI) 및 양전자방출단층촬영(PET-CT)을 시행하였다. 술 후 액체 저류 소견 및 T2 가중 영상에서 액체 저류 주변에 높은 강도의 신호 이외에 전이 소견이 보이지 않아 종양의 광범위 절제술과 재건술을 고려하였다.
국소 재발이 흔한 특성을 고려했을 때 확보해야 하는 절제연에는 아직 논란의 여지가 있지만 영상 검사상 경계가 뚜렷하고 림프절 전이가 없으며 DFSP의 특성상 악성도가 높지 않아 저자들은 1 cm의 절제연을 두고 피부를 포함한 종양절제술을 시행하였다. 종양 아래 광경근을 거상하여 심부 연조직까지 같이 절제하였으며, 종괴와 유착되어 있던 이하선 하부 천엽 부위를 동결절편 검사하여 종양을 확인하였고 하부 이하선 천엽 절제술 시행하였다. 이후 수술실 내 동결절편 검사를 통해 절제연에 병변이 없음을 확인하였다. 예방적인 경부청소술은 시행하지 않았으나 이하선 및 주변 임파선을 일부 같이 절제하였다. 피부 결손은 장경 5.5 cm여서 일차 봉합은 어려웠기 때문에 재건을 위해 경부 피부를 이용한 국소 회전 피판술을 시행하였다(Fig. 4).

Intraoperative, postoperative photographs. A: It was taken after tumor excision with 1 cm free margin. B: Local rotation flap was designed. C: It was taken after dissection. D: It shows post operative wound.
조직 검사에서 3.2 cm의 잔여 DFSP를 확인하였고 섬유지방조직 및 골격근 침범 소견을 보였다. 추가 절제한 이하선 부위에서 0.2 cm의 국소 침범만 있었으며 절제된 7개의 임파선에서 전이 소견은 보이지 않았다. 절제연에 병변이 보이지 않고 종괴의 크기가 크지 않으며 전이 소견이 없어, 보조방사선치료 등의 추가 치료 없이 외래 경과 관찰하였고, 수술 6개월 뒤 시행한 MRI에서 재발의 증거는 보이지 않았다. 피판 회전축 부위 일부 개귀변형과 피부 반흔이 두껍게 형성된 것 이외에 특이 합병증은 보이지 않았고, 수술 후 현재까지 1년 3개월 동안 재발 소견 없이 외래 경과 관찰 중이다(Fig. 5).
고 찰
DFSP는 전체 악성종양의 약 0.1%, 연조직 육종의 6% 미만을 차지하는 희귀한 종양으로, 50대 미만의 성인에서 호발한다[1]. 체간에서 발생하는 DFSP가 약 42%를 차지하며 다음으로는 상지(23%), 하지(18%), 그리고 두경부(13%)에서 발생한다[5].
DFSP는 진피에서 주로 발생하고 피하 조직으로 침윤하나 드물게 본 증례처럼 피하 종양으로 발생하는 경우도 있다[6]. 일반적으로 불규칙한 표면의 딱딱하고 두꺼워진 판형 혹은 결절형의 병변이 보이고 자색, 갈색 혹은 저색소 피부 병변으로 나타날 수 있으며 모세혈관 확장증이 동반될 수 있다[7]. 초기에는 종양이 작고 변화가 미미하여 종양이 성장하며 피부에 두드러질 때까지 인지하지 못하는 경우가 많다. 본 증례의 경우 피부를 포함한 결절형 병변이 촉지되었으나 피부 융기 및 색 변화는 보이지 않아 진단이 어려웠다.
경부 종물에 초기 진단법으로 주로 초음파가 사용된다. 초음파에서 DFSP는 타원형이고 경계가 명확하며 소엽으로 나눠지기도 한다. 내부는 저에코 혹은 혼합성 에코를 보일 수 있으며 후방 음향 증강이 보일 수 있고 말단부에 혈관 형성을 보이기도 한다. CT에서는 경계가 명확하고 골격근과 비슷하게 증강된 종괴가 확인되며 MRI T1 가중 영상에서는 골격근과 비슷한 신호 강도를, T2 가중 영상에서는 대부분 높은 신호 강도를 보였다. 하지만 영상검사만으로는 다른 양성 혹은 악성의 연조직 종양과 감별하기에 제한이 있다[1]. 본 환자는 본원에 내원하기 전 타병원에서 초음파를 시행하였고 경계가 뚜렷한 타원형 모양의 종괴가 보였다. 내부는 혼합성 에코이며 후방 음향 증강을 보이나 말단부 혈관 형성은 명확하지 않았다. CT에서는 이전 연구 결과와 달리 골격근보다 증강되는 종괴를 확인할 수 있었고 경계는 명확하였으며 술전 MRI는 시행하지 않았다.
술전 DFSP 진단을 위한 세침흡인검사에 대한 논문들이 일부 보고되어 있다. DFSP 세침흡인검사에서는 고립된 방추형 세포, 방추형 세포들이 모여 나선형으로 뻗어 있는 스토리폼(storiform) 형태의 조직, 노출된 핵(naked nuclei) 등의 특징을 가지고 있는 경우가 많다. 허나 다른 방추형 세포 종양과 차이가 명확하지 않아 세침흡인검사를 통해 DFSP가 진단된 예는 드물었다[8]. 따라서 세침흡인검사의 필요성은 높지 않으며 확진을 위해서는 생검 조직 검사, 중심부 바늘 생검이 필요하다.
수술 중 임상적으로 악성종양이 의심되는 경우 대부분 동결절편 생검을 시행한다. 허나 이전 연구에서 확인된 DFSP 동결절편 생검의 위음성률은 57%이고[9], 본 증례에서 시행한 동결절편 생검에서도 양성 방추형 세포 종양으로 판단되었다. 때문에 동결절편 생검의 정확도는 떨어진다고 생각되며 상기 검사를 통해 DFSP를 배제하기는 어렵다.
DFSP를 절제 후 거시적으로 보았을 때 흰색에서 노란색으로 보이며 표면이 매끄럽지 않고 주변과 잘 구분되지 않는다. 또한, 종양이 클 경우 내부에 출혈 혹은 낭성 변화가 관찰되기도 한다. Hematoxylin and eosin (H&E) 염색 저배율에서는 세포 흡인검사 결과와 같이 방추형 세포들이 스토리폼 형태로 배열되어 보이고 피하 지방조직 침범 시 벌집 모양도 확인된다. 고배율에서는 과염색(hyperchromasia)된 길어진 세포핵과 작은 양의 세포질을 볼 수 있다. 일반적으로 유사분열 지수는 낮고 이형성도 잘 보이지 않는다. 상기 조직학적 특징과 유사성을 띠는 종양들로 피부섬유종, 슈반세포종, 피부 신경섬유종, 고립성 섬유종, 피내 방추 세포 지방종 등이 있다. 때문에 DFSP 면역조직화학 염색에서 CD34 양성을 보이고 S-100, smooth muscle actin, desmin, XIIIa에서는 음성이 확인된다는 특징을 통해 상기 종양들과 감별하는 것이 필요하다[1,10]. 본 증례에서 종괴는 회백색 단면에 일부 출혈 소견도 동반되었다. 그리고 H&E 염색에서 일반적인 DFSP와 같이 스토리폼 형태, 벌집 모양, 과염색되고 길어진 세포핵, 작은 양의 세포질, 낮은 유사분열지수가 보였다. 또한, 면역조직 화학 염색에서 확인된 CD34 양성, 타염색 음성 소견은 DFSP 진단에 도움이 되었다.
조직 검사로 DFSP는 Bednar, 점액성, 위축성, 섬유육종성 등 다양한 소분류가 가능하다. 그중 10%-15%를 차지하는 섬유육종성 DFSP는 일반적인 DFSP에 비해 악성도가 높고 비정형 방추형 세포가 발견되며 유사분열지수가 높다. 이에 전이율이 높아지고 섬유육종성 변화가 생긴 부위는 CD34 염색에서 음성이 확인된다[10]. 그러나 본 증례에서 섬유육종성 변화가 있는 DFSP 조직은 보이지 않았고 악성도가 낮을 것으로 기대하였다.
DFSP의 주 치료방법은 수술로 알려져 있다. DFSP의 심층 혹은 외측으로의 확장이 빈번하기 때문에 종양의 충분한 절제가 목표이다. 그러나 아직 정립된 수술법은 없어 다양한 수술 방법이 DFSP 치료를 위해 사용되어 왔다. 2-5 cm 정도의 절제연을 확보하여 광범위 절제술을 시행한 증례, Mohs 수술을 시행한 증례 등 다양한 수술법이 사용된 증례가 보고되었다[11]. 본 저자들은 영상검사를 통해 병변의 뚜렷한 경계를 확인하였고 병변의 크기도 크지 않아 두경부 악성종양 치료에 준해서 1 cm 절제연을 확보한 수술을 시행하였다.
DFSP는 임파선 전이가 흔하지 않아 영상검사 혹은 수술 중 전이가 의심되는 경우가 아니라면 예방적 경부청소술을 시행하지 않는다[12]. 국내에서 보고된 증례에서도 예방적 경부청소술을 시행하였으나 임파선 전이는 확인되지 않았고[2], 본 증례에서 제거한 이하선 주위 임파선에서도 전이는 보이지 않았다.
두경부 악성종양 수술 후 피부 결손이 큰 경우 국소피판술 혹은 유리피판술 등이 고려된다. 본 증례에서는 5.5 cm 가량의 결손이 발생하였고 하경부까지 길게 절개선을 넣어 국소 회전 피판술을 시행하였으며 작은 개귀변형 및 수술 부위 반흔 이외에 다른 합병증은 확인되지 않았다.
DFSP에서 항암 치료의 효과는 명확하게 입증되지 않았으나 절제 불가능하거나 재발, 전이성 DFSP의 경우 imatinibe 사용에 대한 FDA 승인이 되어있다. 또한, 보조적 방사선 치료는 안전 절제연을 확보할 수 없는 경우 고려할 수 있다. 일반적으로 안전 절제연이 확보된다면 술후 경과관찰하고 국소 재발시 재수술을 고려한다[1,11,13]. 본 증례는 안전 절제연을 확보하며 수술했고 술후 6개월 뒤 시행한 MRI 및 신체진찰에서도 재발 소견을 보이지 않아 추가적인 치료는 하지 않았다.
DFSP의 전체 생존율은 연구마다 일부 차이가 있으나 91%-100%로 타 악성종양에 비해 높으며 임파선 전이, 원격 전이율은 드문 저등급의 육종으로 평가된다[1]. 국소 재발률은 최대 60%로 보고되며 일반적으로 위족 모양으로 주변 피부나 피하조직으로 종양이 침윤하여 불완전 절제를 통한 국소 재발이 흔하다고 추측되고 있다[11].
원격 전이는 환자군의 5% 미만으로 드물게 발생하고 그중 대부분은 폐로 전이된다[1]. 전이 평가를 위해 PET-CT를 시행하는 것이 중요하고 본원 증례에서 시행한 PET-CT에서 전이 소견은 보이지 않았다.
DFSP의 예후에 대한 연구들에 따르면 고령, 높은 세포밀도, 높은 유사분열 지수(>10/HPF), 현미경적으로 병변과 근접한 절제, DFSP의 섬유육종성 변화 등이 나쁜 예후를 가지고 있다[14]. 본 증례의 경우 상부 절제연이 병변과 0.7 cm로 일부 근접해 있으나 다른 나쁜 예후인자를 포함하지는 않았다. 이에 추가적인 치료 없이 주기적인 경과 관찰을 시행했다.
본 저자들은 피부 양성종양으로 의심됐던 DFSP 환자를 경험하였다. 명확한 경계를 보이고 전이가 없음을 확인한 후 절제연 1 cm의 광범위 절제를 시행하였고 추가로 치료하지는 않았으며 1년 3개월간 재발 소견 없이 추적관찰 중이다. DFSP의 술후 평균 국소 재발 기간이 32-38개월임을 고려하였을 때[10], 더 오랜기간 추적관찰이 필요하나, 본 증례의 치료 과정이 DFSP 치료법에 대한 하나의 좋은 예시라 생각한다.
또한, 이비인후과에 보고된 DFSP 증례가 적어 저자들을 포함해 피부 양성종양으로 오인하여 수술적 절제를 시행하고 추후 DFSP로 진단되는 경우가 많다[2]. 때문에 본 증례와 같은 임상 및 영상소견을 경험하였을 때 DFSP를 염두하여 절개 생검 혹은 중심부 바늘 생검을 시행하기를 바라며 본 증례를 보고하였다.
Acknowledgements
None
Notes
Author Contribution
Conceptualization: Dong Young Kim. Writing—original draft: Yunhyeok Ko. Writing—review & editing: Dong Young Kim.

