 |
 |
AbstractBackground and Objectives Metoclopramide is an antagonist of dopamine D2 receptor and is capable of alleviating chemotherapy-induced nausea and vomiting. However, its underlying mechanisms and function in improving the efficiency of chemotherapy are not fully understood. In this study, we investigated the sensitizing effect of metoclopramide on the platinum-based drugs-mediated apoptosis in human head and neck cancer cells.
Subjects and Method Apoptosis was analyzed using a cell-based cytometer. The protein expression and messenger ribonucleic acid (mRNA) levels were assessed by Western blotting and real-time polymerase chain reaction, respectively.
Results Metoclopramide sensitized the platinum-based drug (cisplatin and oxaliplatin)-mediated apoptosis in AMC-HN4 cells, but not in normal cells. Mechanistically, we found that metoclopramide decreased Mcl-1 protein expression through post-translational regulation. Moreover, the overexpression of Mcl-1 prevented apoptosis by combined treatment of metoclopramide and platinum-based drugs.
ýäť ŰíáŰĹÉŕ▓ŻŰÂÇýĽöýŁÇ ŕÁČŕ░Ľ, ýŁŞŰĹÉ, ÝŤäŰĹÉ Űô▒ Ű░ťý⣠ýťäý╣śýŚÉ Űö░ŰŁ╝ 10ŕ░ť ýŁ┤ýâüýŁś ýäŞŰÂÇ ýĽöýť╝Űíť ŰÂäŰąśŰÉśŰę░, ýí░ýžüÝĽÖýáüýť╝Űíť ýĽŻ 90%ŕ░Ç ÝÄŞÝĆëýâüÝö╝ýäŞÝĆČ ýĽöýóůýŁ┤ŰőĄ[1]. Ű░ťý⣠ŰÂÇýťäýŚÉ Űö░ŰŁ╝ ÝśŞÝŁí ŕ│ĄŰ×Ç, ýŁîýä▒ ý׹ýĽá Űô▒ ýőČŕ░üÝĽť ÝĽęŰ│ĹýŽŁýŁ┤ ŰĆÖŰ░śŰÉśŰę░ ŰőĄŰąŞ ýĽöýŚÉ Ű╣äÝĽ┤ Űéśýüť ýśłÝŤäŰą╝ Ű│┤ýŁŞŰőĄ[2]. ŰĹÉŕ▓ŻŰÂÇýĽöýŁÇ Ű░ťý⣠ýťäý╣ś, ýóůýľĹýŁś ýóůŰąś, ÝÖśý×ÉýŁś ýâüÝâťýŚÉ Űö░ŰŁ╝ ý╣śŰúîŰ▓ĽýŁä ýáĽÝĽśŰę░, ŕ│╝ŕ▒░ýŚÉŰŐö ýłśýłáýáü ý╣śŰúîýŁŞ ýáłýáťýłáŕ│╝ Ű░ęýéČýäá ý╣śŰúîŕ░Ç ýőťÝľëŰÉśýŚłýť╝Űéś ýÁťŕĚ╝ýŚÉŰŐö ýÁťýćîÝĽťýŁś ýáłýáťýłá ÝŤä Ű░ęýéČýäá ý╣śŰúîŰéś ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓ĽýŁä Ű│ĹÝľëÝĽśýŚČ ýłśýłá ÝÜĘŕ│╝Űą╝ ýŽŁŰîÇýőťÝéĄŕ│á ý׳ŰőĄ[3,4].
ŰĹÉŕ▓ŻŰÂÇýĽö ý╣śŰúîŰą╝ ýťäÝĽ┤ 1ý░Ę ýĽŻýáťŰíť ýéČýÜęŰÉśŰŐö platinum ŕŞ░Ű░ś ÝĽşýĽöýáťŰŐö cisplatin, oxaliplatin Ű░Ć carboplatinýŁ┤ ŰîÇÝĹťýáüýŁ┤Űę░, ýäŞÝĆČ Űé┤ ÝĽÁ ýĽłýŚÉ ý╣ĘÝłČÝĽśýŚČ DNAýŁś ýćÉýâüýŁä ýťáŰĆäÝĽśýŚČ ýäŞÝĆČ ŰĆůýä▒ýŁä ýŽŁŕ░ÇýőťÝéĘŰőĄ[5,6]. ÝĽśýžÇŰžî platinum ŕŞ░Ű░ś ÝĽşýĽöýáťŰą╝ ýŁ┤ýÜęÝĽť Ű░śŰ│ÁýáüýŁŞ ý╣śŰúîŰŐö ýśĄÝ׳ŰᥠýóůýľĹ ýäŞÝĆČýŁś DNA ýćÉýâüýŁä ŕĚ╣Ű│ÁÝĽśŕ▓î ÝĽĘýť╝ŰíťýŹĘ Űé┤ýä▒ýŁ┤ ŰéśÝâÇŰéśŕ▓î ŰÉťŰőĄ[7]. ŰśÉÝĽť platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś ÝÜĘŕ│╝ŰŐö ÝÖśý×ÉýŚÉ Űö░ŰŁ╝ Ű░śýŁĹŰąáŕ│╝ ÝÜĘŰŐąýŚÉ ý░ĘýŁ┤ŕ░Ç ŰéśŰę░, ýŁ┤ŰĆůýä▒, ýőáŕ▓ŻŰĆůýä▒ Ű░Ć ŕÁČÝćáýÖÇ ŕ░ÖýŁÇ ŰžÄýŁÇ ŰÂÇý×ĹýÜęýŁ┤ ýťáŰ░ťŰÉťŰőĄ[8]. Űö░ŰŁ╝ýäť platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť Űé┤ýä▒ Ű░Ć ŰÂÇý×ĹýÜęýŁä ýÁťýćîÝÖöýőťÝéĄŕ│á ŕ░Éýłśýä▒ýŁä ýŽŁŕ░ÇýőťÝéĄŕŞ░ ýťäÝĽť ýŚ░ŕÁČŕ░Ç ýžÇýćŹŰÉśŕ│á ý׳ŰőĄ[9]. ŰîÇÝĹťýáüýť╝Űíť 5-ÝöîŰúĘýśĄŰíťýÜ░ŰŁ╝ýőĄ(5-fluorouracil)ýŁÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť ýáÇÝĽşýä▒ýŁä ŕĚ╣Ű│ÁÝĽá ýłś ý׳ýť╝Űę░ ŰĹÉ ÝĽşýĽöýáťýŁś Ű│ĹýÜęý▓śŰŽČŰŐö ŰŤ░ýľ┤Űéť ÝĽşýĽö ÝÜĘŕ│╝Űą╝ ŰéśÝâÇŰéŞŰőĄ[10]. ýÁťŕĚ╝ýŚÉŰŐö 1ý░Ę platinum ŕŞ░Ű░ś ÝĽşýĽöýáťŕ░Ç ŕ░ÇýžÇŰŐö ŰÂÇý×ĹýÜęýŁŞ ýäŞÝĆČ ŰĆůýä▒, ý╣ťýťáýä▒ Ű░Ć ýłśŰĆÖýáüýŁŞ ýĽŻŰČ╝ ýáäŰőČýŁä ŕ░ťýäáÝĽť ýâłŰíťýÜ┤ platinum ÝĽşýĽöýáť ŕ░ťŰ░ťýŚÉ ýĽáýô░ŕ│á ý׳ŰőĄ[9,11]. ÝĽşýĽö ÝÜĘŕ│╝ŕ░Ç ŰŤ░ýľ┤Űéśŕ│á ýáüýŁÇ ŰÂÇý×ĹýÜęýŁä ŕ░Çýžä ýâłŰíťýÜ┤ ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť ŕ░ťŰ░ťýŁ┤ ýžÇýćŹŰÉśŕ│áŰŐö ý׳ýť╝Űéś Ýü░ Ű╣äýÜęŕ│╝ ŰžÄýŁÇ ýőťŕ░äýŁ┤ ÝĽäýÜöÝĽśŕŞ░ ŰĽîŰČŞýŚÉ ŕŞ░ýí┤ ÝĽşýĽöýáťýÖÇ ÝâÇ ýĽŻŰČ╝ýŁś Ű│ĹÝĽę ýÜöŰ▓ĽýŁä ÝćÁÝĽ┤ ÝĽşýĽö ÝÜĘŕ│╝Űą╝ ýŽŁŰîÇÝĽśŰŐö ŰŹ░ ŕ┤ÇýőČýŁ┤ ŰćĺýĽäýžÇŕ│á ý׳ŰőĄ.
ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓ĽýŚÉ ýŁśÝĽ┤ ŰéśÝâÇŰéśŰŐö ŰęöýŐĄŕ║╝ýŤÇŕ│╝ ŕÁČÝćáŰŐö ýŁ╝Ű░śýáüýŁŞ ýŽŁýâüýŁ┤ýžÇŰžî ŕ│╝ŰĆäÝĽśŕ▓î ýžÇýćŹýáüýť╝Űíť ýťáŰ░ťŰÉá ŕ▓ŻýÜ░ ýĽö ÝÖśý×ÉýŁś ýéÂýŁś ýžłýŁä Űé«ýÂöŕ│á ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓ĽýŁś ÝÜĘŕ│╝Űą╝ ŕ░ÉýćîýőťÝéĘŰőĄ. Ű»ŞŕÁş ýóůÝĽę ýĽö ŰäĄÝŐŞýŤîÝüČ ý×äýâü ýžäŰúî ýžÇý╣Ę(National Comprehensive Cancer Network guideline)ýŚÉ Űö░Űą┤Űę┤ ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓Ľ ýőť ŰéśÝâÇŰéśŰŐö ŰÂÇý×ĹýÜę ÝĽśŰéśýŁŞ ŕÁČÝćáŰą╝ ýľÁýáťÝĽśŰŐö ýĽŻŰČ╝Űíť metoclopramide, ondansetron Ű░Ć palonosetronýŁś ýéČýÜęýŁä ŕÂîŕ│áÝĽśŕ│á ý׳ŰőĄ[12]. ýśĄŰלýáä ŰĹÉŕ▓ŻŰÂÇ ýĽöýäŞÝĆČŰą╝ ýŁ┤ýÜęÝĽť ýŁ┤ýóůýŁ┤ýőŁŰĆÖŰČ╝۬ĘŰŹŞýŚÉýäť metoclopramideýÖÇ cisplatinýŁś Ű│ĹýÜęý▓śŰŽČýŚÉ Űö░ŰąŞ ÝĽşýĽö ýâüýŐ╣ÝÜĘŕ│╝Űą╝ ÝÖĽýŁŞÝĽśýśÇýť╝Űéś ŰÂäý×Éýáü ŕŞ░ýáäýŚÉ ŰîÇÝĽť ýŚ░ŕÁČŰŐö Ű│┤ŕ│áŰÉśýžÇ ýĽŐýĽśŰőĄ[13]. Ondansetronŕ│╝ ŕ░ÖýŁÇ ýäŞŰíťÝćáŰőî ýłśýÜęý▓┤ પݼşýáť(antagonist)ýÖÇ ŰőČŰŽČ metoclopramideŰŐö ŰĆäÝîîŰ»╝ D2 ýłśýÜęý▓┤ŰĆä ýáťýľ┤ÝĽá ýłś ý׳ŰŐö પݼşýáťŰíť ýĄĹýÂöýőáŕ▓Żŕ│äýŁś ŰĆäÝîîŰ»╝ ýłśýÜęý▓┤ýŁś ŕŞ░ŰŐąýŁä ÝĽĘŕ╗ś ý░ĘŰőĘÝĽśýŚČ ŕÁČÝćáŰą╝ ýľÁýáťÝĽťŰőĄ. ŰśÉÝĽť ŰőĄŰąŞ ÝĽş ŕÁČÝćáýáťŰ│┤ŰőĄ ŕ░Çŕ▓ęýŁ┤ ýáÇŰá┤ÝĽ┤ ÝÖśý×ÉýŚÉŕ▓î ŕ▓ŻýáťýáüýŁŞ ŰÂÇŰő┤ýŁ┤ ýáüŰőĄ[14]. ýŁ┤ýáä Ű│┤ŕ│áŰą╝ ÝćÁÝĽ┤ ŰĆäÝîîŰ»╝ D2 ýłśýÜęý▓┤ýŁś Ű░ťÝśäýŁ┤ ŰćĺýŁÇ ýóůýľĹ ýí░ýžüýŚÉýäť ŰĆäÝîîŰ»╝ D2 ýłśýÜęý▓┤ પݼşýáťýŁś ÝĽşýĽö ÝÜĘŕ│╝Űą╝ ÝÖĽýŁŞÝĽśýśÇýť╝Űę░, ýÁťŕĚ╝ metoclopramideŕ░Ç ýé╝ýĄĹýŁîýä▒ýťáŰ░ęýĽö ýäŞÝĆČýŁś ýŽŁýőŁýŁä Űžëŕ│á ýéČŰęŞýŁä ýťáŰĆäÝĽťŰőĄŕ│á Ű│┤ŕ│áŰÉśýŚłŰőĄ[15,16].
Ű│Ş ýŚ░ŕÁČýŚÉýäťŰŐö metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýÖÇýŁś Ű│ĹÝĽę ý╣śŰúîŕ░Ç ŰĹÉŕ▓ŻŰÂÇ ýĽöýäŞÝĆČýŁś ýéČŰęŞ ÝÜĘŕ│╝Űą╝ ýŽŁýžäýőťÝéĄŰŐöýžÇ ÝÖĽýŁŞÝĽśŕ│á ŕĚŞ ŕŞ░ýáäýŁä ŕ̝۬ůÝĽ┤ ÝĽşýĽöýáťýŁś Űé┤ýä▒ Ű░Ć ŰÂÇý×ĹýÜęýŁä ýĄäýŁ╝ ýłś ý׳ŰŐö ýâłŰíťýÜ┤ ý╣śŰúî ýÜöŰ▓Ľýť╝ŰíťýŁś ŕ░ÇŰŐąýä▒ýŁä ýáťýőťÝĽśŕ│áý×É ÝĽśýśÇŰőĄ.
ŰîÇýâü Ű░Ć Ű░ęŰ▓ĽýäŞÝĆČ Ű░░ýľĹ Ű░Ć ýőťýĽŻŰ│Ş ýŚ░ŕÁČýŚÉ ýéČýÜęŰÉť ýŁŞŕ░ä ŰĹÉŕ▓ŻŰÂÇ ÝÄŞÝĆëýäŞÝĆČýĽöýóůýŁŞ AMC-HN4ýÖÇ AMC-HN6 ýäŞÝĆČŰŐö ýĽäýé░Ű│ĹýŤÉýŚÉýäť ŰÂäýľĹ Ű░ŤýĽśŕ│á, ýáĽýâü Ýśłŕ┤Ç ŕ░äýäŞÝĆČ(mesangial cell, MC)ýÖÇ ýÜöýäŞŕ┤ÇýâüÝö╝ýäŞÝĆČ(kidney epithelial cells, TCMK-1)ŰŐö American Type Culture Collection (Manassas, VA, USA)ýŚÉýäť ŕÁČý×ůÝĽśýśÇŰőĄ. ýäŞÝĆČýú╝ Ű░░ýľĹýŁä ýťäÝĽť Ű░░ýžÇŰŐö 10% ÝâťýĽäýÜ░Ýśłý▓ş(fetal bovine serum; Welgene, Gyeongsan, Korea)ŕ│╝ 1% antibiotics (Gibco BRL, New York, NY, USA)ýŁä ý▓Ęŕ░ÇÝĽť DulbeccoÔÇÖs Modified EagleÔÇÖs Medium (Welgene)ýŁä ýéČýÜęÝĽśýśÇýť╝Űę░ 37┬░CŰíť ýťáýžÇŰÉśŰŐö 5% CO2 Ű░░ýľĹŕŞ░Űą╝ ýŁ┤ýÜęÝĽśýŚČ Ű░░ýľĹÝĽśýśÇŰőĄ. ýőĄÝŚśýŚÉ ýéČýÜęŰÉť ýĽŻýáťýŁŞ metoclopramide, cisplatin, oxaliplatin, cycloheximide, MG132, lactacystin Ű░Ć actin ÝĽşý▓┤ŰŐö Sigma (Saint Louis, MO, USA)ýŚÉýäť, z-VAD-fmkŰŐö Calbiochem (San Diego, CA, USA)ýŚÉýäť ŕÁČý×ůÝĽśýśÇŰőĄ. PARP, Bcl-2, Mcl-1, Bcl-xL, Bax, cIAP1, cIAP2 Ű░Ć DR5 ÝĽşý▓┤ŰŐö Cell Signaling Technology (Beverly, MA, USA)ýŚÉýäť ŕÁČý×ůÝĽśýśÇŕ│á, c-FLIP ÝĽşý▓┤ŰŐö Enzo Life Sciences (San Diego, CA, USA)ýŚÉýäť ŕ░üŕ░ü ŕÁČŰžĄÝĽśýśÇŰőĄ.
ýťáýäŞÝĆČ ŰÂäýäŁAMC-HN4 1├Ś106ŕ░ťýŁś ýäŞÝĆČŰą╝ 100 ╬╝LýŁś phosphate-buffered salineŰą╝ Űäúýľ┤ ýל ÝĺÇýľ┤ýĄÇ ÝŤä, 200 ╬╝LýŁś 95% ethanolýŁä ýžäÝ⼠ݜ╝ÝĽęÝĽśŰę┤ýäť ýí░ýőČýŐĄŰčŻŕ▓î Űäúýľ┤ýú╝ýŚłŰőĄ. ýäŞÝĆČŰą╝ 4┬░CýŚÉýäť 1ýőťŕ░ä ŰĆÖýĽł ŕ│áýáĽÝĽť ÝŤä, 250 ╬╝LýŁś 1.12% sodium citrate bufferýŚÉ 12.5 ╬╝g RNaseŕ░Ç Űů╣ýĽä ý׳ŰŐö ýÜęýĽíýŁä Űäúýľ┤ 37┬░CýŚÉýäť 30ŰÂäŕ░ä Ű░░ýľĹÝĽśýśÇŰőĄ. ŕĚŞ ÝŤä 250 ╬╝L propidium iodide (50 ╬╝g/mL)Űą╝ Űäúýľ┤ ýäŞÝĆČŰą╝ ýŚ╝ýâë ÝŤä, BD AccuriÔäó C6 flow cytometer (BD Biosciences, San Jose, CA, USA)Űą╝ ýŁ┤ýÜęÝĽśýŚČ sub-G1ŕŞ░Űą╝ ŰÂäýäŁÝĽśýśÇŰőĄ.
Western blottingýłśŕ▒░ŰÉť ýäŞÝĆČýŚÉ lysis buffer (137 mM NaCl, 15 mM EGTA, 0.1 mM sodium orthovanadate, 15 mM MgCl2, 0.1% TritonX-100, 100 mM phenyl methyl sulfonyl fluoride, 20 mM leupeptin, pH7.2)Űą╝ ý▓Ęŕ░ÇÝĽśŕ│á ýžäÝ⼠ݜ╝ÝĽęÝĽśýŚČ ýäŞÝĆČŰą╝ ÝîîýçäÝĽť ÝŤä, 13000 rpmýť╝Űíť 15ŰÂäŕ░ä ýŤÉýőČ ŰÂäŰŽČÝĽśýŚČ ýâüýŞÁýŁä ýłśŕ▒░ÝĽśýśÇŰőĄ. Sodium dodecyl sulfate polyacrylamide gel electrophoresisýŁä ýŁ┤ýÜęÝĽśýŚČ ýáäŕŞ░ ýśüŰĆÖ ÝŤä immobilon membrane (Milipore, Billerica, MA, USA)ýŚÉ ŰőĘŰ░▒ýžłýŁä ýŁ┤ŰĆÖýőťÝéĄŕ│á ýŁ╝ý░Ę ÝĽşý▓┤Űą╝ ýőĄýśĘýŚÉýäť Ű░Ąýâł Ű░śýŁĹýőťý╝░ŰőĄ. ýŁ┤ý░Ę ÝĽşý▓┤ýÖÇ ýőĄýśĘýŚÉýäť 2ýőťŕ░ä Ű░śýŁĹ ÝŤä enhanced chemiluminoscence (Pierce, Rockford, IL, USA) ýÜęýĽíýŁä ýŁ┤ýÜęÝĽśýŚČ ÝŐ╣ýŁ┤ýáüýŁŞ ŰőĘŰ░▒ýžłýŁä ŕ▓ÇýݼśýśÇŰőĄ.
DNA ŰőĘÝÄŞÝÖö ŰÂäýäŁÝĽÁýŁś ŰÂäýáłýŁä ÝÖĽýŁŞÝĽśŕŞ░ ýťäÝĽśýŚČ 4',6-diamidino-2-phenylndole (DAPI) ýŚ╝ýâëŰ▓ĽýŁä ýőťÝľëÝĽśýśÇŰőĄ. ýőťŰúîŰą╝ ý▓śŰŽČÝĽť ýäŞÝĆČýŚÉ DAPI ýŚ╝ýâëýĽŻýŁä ý▓Ęŕ░ÇÝĽśýŚČ 5ŰÂäŕ░ä ýŚ╝ýâëÝĽśŕ│á ÝśĽŕ┤Ĺ ÝśäŰ»Şŕ▓Żýť╝Űíť ÝĽÁýŁś Ű│ÇÝÖöŰą╝ ŕ┤Çý░░ÝĽśýśÇŰőĄ. DNA ŰőĘÝÄŞÝÖö ÝśäýâüýŁś ŰÂäýäŁýŁä ýťäÝĽśýŚČ cell death detection ELISA plus kit (Boehringer Mannheim corporation, Indianapolis, IN, USA)Űą╝ ýéČýÜęÝĽśýśÇŰőĄ. ýŤÉýőČ ŰÂäŰŽČÝĽśýŚČ ýâüýŞÁýĽíýŁä ýáťŕ▒░ÝĽśŕ│á ýäŞÝĆČýŚÉ lysis bufferŰą╝ 200 ╬╝L ŰäúýŁÇ ÝŤä ýâüýśĘýŚÉýäť 30ŰÂäŕ░ä ýÜęÝĽ┤ýőťÝéĘŰőĄ. ýŤÉýőČ ŰÂäŰŽČÝĽśýŚČ ýľ╗ýŁÇ ýâüýŞÁýĽí 100 ╬╝LýŚÉ anti-histone ÝĽşý▓┤ýÖÇýŁś Ű░śýŁĹ ÝŤä ŕ│╝ýé░ÝÖöÝÜĘýćî ŕŞ░ýžłýŁä Űäúýľ┤ ŰÂäŕ┤ĹýŞíŕ┤ĹŕŞ░Űą╝ ýŁ┤ýÜęÝĽśýŚČ 405 nm ÝŁíŕ┤ĹŰĆäŰą╝ ýŞíýáĽÝĽśýśÇŰőĄ.
Caspase ÝÖťýä▒ ýŞíýáĽCaspase ÝÖťýä▒ÝÖöŰą╝ ýŞíýáĽÝĽśŕŞ░ ýťäÝĽśýŚČ 20 ╬╝gýŁś ŰőĘŰ░▒ýžłýŁä caspase substrate (Asp-Glu-Val-Asp-chromophore-p-nitroanilide [DVAD-pNA])ŕ░Ç ŰôĄýľ┤ý׳ŰŐö 100 ╬╝LýŁś Ű░śýŁĹ Ű▓äÝŹ╝(1% NP-40, 20 mM Tris-HCl, pH 7.5, 137 mM NaCl, 10% glycerol)ýŚÉ ý▓Ęŕ░Ç ÝŤä 37┬░CýŚÉýäť 2ýőťŕ░ä Ű░śýŁĹýőťý╝░ŰőĄ. ŰÂäŕ┤Ĺ ýŞíŕ┤ĹŕŞ░Űą╝ ýŁ┤ýÜęÝĽśýŚČ 405 nm ÝŁíŕ┤ĹŰĆäŰą╝ ýŞíýáĽÝĽśýśÇŰőĄ.
ÝśĽýžł ýú╝ý×ů(transfection)AMC-HN4 ýäŞÝĆČýŚÉ Mcl-1ýŁä ŕ│╝Ű░ťÝśäýőťÝéĄŕŞ░ ýťäÝĽ┤ pcDNA3.1/Mcl-1 ÝöîŰŁ╝ýŐĄŰ»ŞŰôťŰą╝ LipofectamineTM 2000 (Thermo Fisher Scientific, Waltham, MA, USA)ýŁä ýŁ┤ýÜęÝĽśýŚČ ÝśĽýžł ýú╝ý×ů ÝŤä 24ýőťŕ░ä ŰĆÖýĽł 37┬░CŰíť ýťáýžÇŰÉśŰŐö 5% CO2 Ű░░ýľĹŕŞ░Űą╝ ýŁ┤ýÜęÝĽśýŚČ Ű░░ýľĹÝĽśýśÇŰőĄ.
ýőĄýőťŕ░ä ýĄĹÝĽę ÝÜĘýćî ýŚ░ýçä Ű░śýŁĹ(quantitative polymerase chain reaction)TRIzol reagent (Life Technologies, Carlsbad, CA, USA)Űą╝ ýŁ┤ýÜęÝĽśýŚČ RNAŰą╝ ýÂöýݼśýśÇŰőĄ. 2 ╬╝gýŁś RNAŰą╝ M-MLV reverse transcriptase (Gibco BRL)Űą╝ ýŁ┤ýÜęÝĽśýŚČ complementary DNA (cDNA)Űą╝ ÝĽęýä▒ÝĽśŕ│á ŕ░üŕ░üýŁś ýťáýáäý×É ÝŐ╣ýἠÝöäŰŁ╝ýŁ┤ŰĘŞŰą╝ ýŁ┤ýÜęÝĽśýŚČ quantitative polymerase chain reaction (qPCR)ýŁä ýłśÝľëÝĽśýśÇŰőĄ. ýťáýáäý×É ÝöäŰŁ╝ýŁ┤ŰĘŞ ýáĽŰ│┤ŰŐö ŰőĄýŁîŕ│╝ ŕ░ÖŰőĄ; Mcl-1 (forward) 5'ÔÇôTCC TGA TGC CAC CTT CTA GG-3', (reverse) 5'ÔÇô ATG CTT CGG AAA CTG GAC AT-3'; actin (forward) 5'- TGG GGT GTT GAA GGT CTC-3', (reverse) 5'- CTACAATGAGCTGCGTGTG-3'.
ÝćÁŕ│äÝĽÖýáü ŰÂäýäŁŰ¬ĘŰôá ýőĄÝŚś ŕ▓░ŕ│╝ýŁś ÝćÁŕ│ä ŰÂäýäŁýŁÇ SPSS ver. 22.0 (IBM Corp., Armonk, NY, USA)ýŁä ýéČýÜęÝĽśýŚČ ÝĆëŕĚá(mean)┬▒ÝĹťýĄÇÝÄŞý░Ę(standard deviation)Űíť ŰéśÝâÇŰâłŰőĄ. ŕ░ü ýőĄÝŚś ŕÁ░ýŁś ŰÂäýäŁ ÝĽşŰ¬ęŰ│ä ÝćÁŕ│äýŁś ýťáýŁśýä▒ ŕ▓ÇýŽŁýŁÇ ŰÂäýé░ŰÂäýäŁ(analysis of vatiance, ANOVA)ýŁä ýőťÝľëÝĽť ŰĺĄ StudentÔÇÖs t-testŰą╝ ýŁ┤ýÜęÝĽśýŚČ pŕ░ĺýŁ┤ 0.05 ýŁ┤ÝĽśýŁ╝ ŕ▓ŻýÜ░ ýťáýŁśÝĽśŰőĄŕ│á ÝîÉýáĽÝĽśýśÇŰőĄ.
ŕ▓░ ŕ│╝ŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČýŚÉýäť metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞ ÝÖĽýŁŞŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČýŚÉýäť metoclopramideýŁś ŰĆůýä▒ýŁä ÝÖĽýŁŞÝĽśŕ│áý×É XTT ŕŞ░Ű▓ĽýŁä ýŁ┤ýÜęÝĽśýŚČ ýâŁý׹ýťĘýŁä ÝÖĽýŁŞÝĽśýśÇŰőĄ. AMC-HN4ýÖÇ AMC-HN6 ŰĹÉ ýóůŰąśýŁś ŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČýŚÉ metoclopramideŰą╝ 0.1-5 mMŕ╣îýžÇ ŰőĄýľĹÝĽť ŰćŹŰĆäŰíť ý▓śŰŽČÝĽśýśÇýŁä ŰĽî, 1 mMŰÂÇÝä░ ýĽöýäŞÝĆČ ýâŁý׹ýťĘýŁ┤ 20% ýŁ┤ýâü ŕ░ÉýćîŰÉśýŚłŰőĄ(Supplementary Fig. 1A). Annexin V ýŚ╝ýâëŰ▓ĽýŁä ýŁ┤ýÜęÝĽśýŚČ ýéČŰęŞýŁä ÝÖĽýŁŞÝĽśýśÇýŁä ŰĽîŰĆä AMC-HN4 ýäŞÝĆČýŚÉýäť metoclopramide 1 mMŰÂÇÝä░ ýäŞÝĆČýéČŰęŞýŁ┤ ýťáŰĆäŰÉśýŚłŰőĄ(Supplementary Fig. 1B). Űö░ŰŁ╝ýäť ŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČýŚÉýäť metoclopramideýŁś ŰĆůýä▒ýŁ┤ ŰéśÝâÇŰéśýžÇ ýĽŐŰŐö 0.5 mMýŁś ŰćŹŰĆäŰą╝ ýäáýáĽÝĽśŕ│á ÝĽşýĽöýáť Ű»╝ŕ░ÉÝÖö ýŽŁýžäýŚÉ ŰîÇÝĽť ýŚ░ŕÁČŰą╝ ýžäÝľëÝĽśýśÇŰőĄ.
AMC-HN4 ýäŞÝĆČýŚÉýäť metoclopramideýŁ┤ ŕŞ░ýí┤ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť ýĽöýäŞÝĆČ ýéČŰęŞ ýŽŁýžä ŕ░ÇŰŐąýä▒ýŁä ÝÖĽýŁŞÝĽśŕŞ░ ýťäÝĽ┤ ýáÇŰćŹŰĆäýŁś metoclopramideýÖÇ cisplatin ŰśÉŰŐö oxaliplatinýŁä ý▓śŰŽČÝĽśýśÇŰőĄ. ýáÇŰćŹŰĆäýŁś ŕ░üŕ░üýŁś ýĽŻŰČ╝ ŰőĘŰĆů ý▓śŰŽČŰŐö ýäŞÝĆČýéČŰęŞýŁ┤ ýŁ╝ýľ┤ŰéśýžÇ ýĽŐýžÇŰžî metoclopramideŕ│╝ cisplatin ŰśÉŰŐö metoclopramideŕ│╝ oxaliplatin Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽ┤ ýäŞÝĆČýéČŰęŞýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ŰŐö sub-G1ŕŞ░ýŁś ýŽŁŕ░Ç Ű░Ć PARP ŰÂäýáłýŁä ÝÖĽýŁŞÝĽśýśÇŰőĄ(Fig. 1A). DAPI ýŚ╝ýâëŰ▓ĽýŁä ÝćÁÝĽ┤ ÝśĽŕ┤ĹÝśäŰ»Şŕ▓Żýť╝Űíť ÝĽÁýŁś ÝśĽÝâťŰą╝ ÝÖĽýŁŞÝĽť ŕ▓░ŕ│╝ metoclopramideýÖÇ cisplatin ŰśÉŰŐö oxaliplatin Ű│ĹÝĽęý▓śŰŽČŰŐö ÝĽÁýŁś ýŁĹýÂĽýŁä ýťáŰĆäÝĽśŰę░ oligonucleosome associated histone kitŰą╝ ýŁ┤ýÜęÝĽśýŚČ ŰśÉÝĽť Ű│ĹÝĽęý▓śŰŽČ ýőť DNA ŰÂäýáłýŁ┤ ýŽŁŕ░ÇÝĽśýśÇŰőĄ(Fig. 1B and C). MetoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞýŚÉ caspaseýŁś ýŁśýí┤ýä▒ýŁä ŕ̝۬ůÝĽśŕŞ░ ýťäÝĽ┤ýäť caspase-3ýŁś ÝÖťýä▒ÝÖö ýáĽŰĆäŰą╝ ÝÖĽýŁŞÝĽśýśÇýŁä ŰĽî ýťáýŁśýáüýť╝Űíť metoclopramideýÖÇ cisplatin ŰśÉŰŐö oxaliplatin Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽśýŚČ caspase-3 ÝÖťýä▒ÝÖöŕ░Ç ýŽŁŕ░ÇÝĽśýśÇŰőĄ(Fig. 1D). Caspase ýáÇÝĽ┤ýáťýŁŞ z-VADýŁś ýáäý▓śŰŽČŰŐö ŰĹÉ ýĽŻŰČ╝ýŁś Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽ┤ ýŽŁŕ░ÇÝĽśŰŐö ýäŞÝĆČýéČŰęŞ Ű░Ć caspase-3ýŁś ŰÂäýáłýŁä ýľÁýáťÝĽśýśÇŰőĄ(Fig. 1E). ýŁ┤ ŕ▓░ŕ│╝Űíť metoclopramideýŁÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť Ű»╝ŕ░ÉÝÖöŰą╝ ýŽŁýžäýőťÝéĄŕ│á ŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČýéČŰęŞýŁä ýťáŰĆäÝĽśŰŐö ŕ▓âýŁä ÝÖĽýŁŞÝĽśýśÇŰőĄ.
MetoclopramideýŚÉ ýŁśÝĽť Mcl-1 Ű░ťÝśä ŕ░ÉýćîýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáť ýťáŰĆä ýäŞÝĆČýéČŰęŞ ŕ┤ÇŰáĘýä▒MetoclopramideýŚÉ ýŁśÝĽť platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞ ýťáŰĆä ŕŞ░ýáäýŁä ÝÖĽýŁŞÝĽśŕŞ░ ýťäÝĽśýŚČ metoclopramide ŰőĘŰĆů ý▓śŰŽČýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞ ŕ┤ÇŰáĘ ŰőĘŰ░▒ýžłýŁś Ű░ťÝśäýŁä ýí░ýéČÝĽśýśÇŰőĄ. ŰĹÉ ýóůŰąśýŁś ŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČýŁŞ AMC-HN4ýÖÇ AMC-HN6 ýäŞÝĆČýŚÉ metoclopramideŰą╝ ŰćŹŰĆäŰ│äŰíť ý▓śŰŽČÝĽśýśÇýŁä ŰĽî ŰőĄŰąŞ ýäŞÝĆČýéČŰęŞ ŕ┤ÇŰáĘ ŰőĘŰ░▒ýžłýŁś Ű░ťÝśä Ű│ÇÝÖöŰŐö ýŚćýŚłýť╝Űéś anti-apoptotic Bcl-2 ŰőĘŰ░▒ýžł ýĄĹ ýśĄýžü Mcl-1ýŁś Ű░ťÝśäýŁ┤ ŕ░ÉýćîÝĽśýśÇŰőĄ(Fig. 2A). Mcl-1ýŁś Ű░ťÝśä ŕ░Éýćîŕ░Ç metoclopramideŕ│╝ platinum ŕŞ░Ű░ś ÝĽşýĽöýáť Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞýŚÉ ŕ┤ÇýŚČÝĽśŰŐöýžÇ ŕ̝۬ůÝĽśŕŞ░ ýťäÝĽśýŚČ Mcl-1ýŁ┤ ŕ│╝Ű░ťÝśäŰÉť ýĽöýäŞÝĆČŰą╝ ýéČýÜęÝĽśýśÇŰőĄ. Mcl-1ýŁś Ű░ťÝśäýŁ┤ ŰćĺýŁä ŰĽî metoclopramideýÖÇ cisplatin ŰśÉŰŐö oxaliplatin Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽť sub-G1ŕŞ░ ýŽŁŕ░Ç Ű░Ć PARP ŰÂäýáłýŁ┤ ýľÁýáťŰÉśýŚłŰőĄ(Fig. 2B). ýŁ┤ ŕ▓░ŕ│╝Űíť Mcl-1 ŕ│╝Ű░ťÝśäŰÉť ýäŞÝĆČýŚÉýäťŰŐö metocloprimideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś Ű│ĹýÜę ÝÜĘŕ│╝ŕ░Ç ýĽŻÝÖöŰÉĘýŁä ýĽî ýłś ý׳ŰőĄ.
AMC-HN4 ýäŞÝĆČŰŐö metoclopramideýŁś ŰćŹŰĆä 0.2 mMŰÂÇÝä░ Mcl-1 Ű░ťÝśäýŁ┤ ŕ░ÉýćîÝĽśýžÇŰžî AMC-HN6 ýäŞÝĆČýŚÉýäťŰŐö ŰćŹŰĆä 1 mMŰÂÇÝä░ Mcl-1ýŁś Ű░ťÝśäýŁä ŕ░ÉýćîýőťÝéĘŰőĄ(Fig. 2A). ŰĹÉ ýóůŰąśýŁś ŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČýú╝Űą╝ Ű╣äŕÁÉÝĽśŰę┤ AMC-HN4 ýäŞÝĆČýŚÉýäť metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáť Ű│ĹýÜęý▓śŰŽČýőť ŰŹöýÜ▒ ŰŤ░ýľ┤Űéť ÝĽşýĽöÝÜĘŕ│╝Űą╝ ÝÖĽýŁŞÝĽá ýłś ý׳ŰőĄ(Supplementary Fig. 2). ýŁ┤ ŕ▓░ŕ│╝Űíť metoclopramideýŚÉ ýŁśÝĽť Mcl-1ýŁś ŕ░Éýćîŕ░Ç platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞ ýťáŰĆäýŚÉ ýĄĹýÜöÝĽť ýŁŞý×Éý×äýŁä ýĽî ýłś ý׳ŰőĄ.
Ű▓łýŚş ÝŤä ŰőĘŕ│äŰą╝ ÝćÁÝĽť metoclopramideýŁś Mcl-1ýŁś Ű░ťÝśä ýí░ýáłMetoclopramideýŁś ý▓śŰŽČýŚÉ ýŁśÝĽť Mcl-1ýŁś Ű░ťÝśä ýí░ýáł ŰőĘŕ│äŰą╝ ýí░ýéČÝĽśýśÇŰőĄ. ŰĘ╝ýáÇ qPCRýŁä ýŁ┤ýÜęÝĽť messenger ribonucleic acid (mRNA) Ű░ťÝśä ýí░ýéČŰą╝ ÝćÁÝĽ┤ ýáäýéČ ŰőĘŕ│ä ýí░ýáłýŁä ÝÖĽýŁŞÝĽśýśÇýť╝Űéś metoclopramideýŚÉ ýŁśÝĽ┤ Mcl-1ýŁś mRNAýŁś Ű│ÇÝÖöŰŐö ýŚćýŚłŰőĄ(Fig. 3A). MetoclopramideýŁś Ű▓łýŚş ÝŤä ŰőĘŕ│äŰą╝ ÝćÁÝĽť Mcl-1ýŁś Ű░ťÝśä ýí░ýáłýŁä ÝÖĽýŁŞÝĽśŕŞ░ ýťäÝĽ┤ ŰőĘŰ░▒ýžł ÝĽęýä▒ ýáÇÝĽ┤ýáťýŁŞ cycloheximide (CHX)Űą╝ ýŁ┤ýÜęÝĽśýśÇŰőĄ. CHXýŁś ýáäý▓śŰŽČŰą╝ ÝćÁÝĽ┤ ýâłŰíťýÜ┤ ŰőĘŰ░▒ýžłýŁś ÝĽęýä▒ýŁ┤ ýŁ╝ýľ┤ŰéśýžÇ ýĽŐýŁä ŰĽî metoclopramide ý▓śŰŽČýőť Mcl-1ýŁ┤ ŰŹö ŕŞëŕ▓ęÝĽśŕ▓î ŰÂäÝĽ┤ŰÉśýŚłŰőĄ(Fig. 3B). ŰőĘŰ░▒ýžłýŁś ŰÂäÝĽ┤ŰŐö ÝöäŰíťÝůîýĽäýóÇýŁś ÝÖťýä▒ÝÖöŕ░Ç ýĄĹýÜöÝĽśŰę░, Fig. 3BýŁś ŕ▓░ŕ│╝Űą╝ Ű░öÝâĽýť╝Űíť metoclopramideýŚÉ ýŁśÝĽť Mcl-1ýŁś Ű░ťÝśä ŕ░ÉýćîýŚÉ ÝöäŰíťÝůîýĽäýóÇýŁś ŕ┤ÇŰáĘýä▒ýŁä ŕ̝۬ůÝĽśŕŞ░ ýťäÝĽśýŚČ ÝöäŰíťÝůîýĽäýóÇ ÝÖťýä▒ ýáÇÝĽ┤ýáťýŁŞ MG132ýÖÇ lactacystinýŁä ýŁ┤ýÜęÝĽśýŚČ ŰőĘŰ░▒ýžłýŁś Ű│ÇÝÖöŰą╝ ýí░ýéČÝĽśýśÇŰőĄ. MetoclopramideýŚÉ ýŁśÝĽ┤ ŕ░ÉýćîŰÉť Mcl-1ýŁś ŰőĘŰ░▒ýžł Ű░ťÝśäýŁÇ ÝöäŰíťÝůîýĽäýóÇ ÝÖťýä▒ ýáÇÝĽ┤ýáťýŚÉ ýŁśÝĽ┤ ýľÁýáťŰÉśýŚłŰőĄ(Fig. 3C). ýŁ┤ ŕ▓░ŕ│╝Űíť metoclopramideŰŐö Ű▓łýŚş ÝŤä ŰőĘŕ│äŰą╝ ÝćÁÝĽ┤ Mcl-1ýŁś ŰőĘŰ░▒ýžłýŁä ŰÂäÝĽ┤ÝĽśŰŐö ŕ▓âýŁä ýĽî ýłś ý׳ŰőĄ.
ýáĽýâü ýäŞÝĆČýŚÉýäť metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáť Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞ Ű░śýŁĹýáĽýâüýäŞÝĆČýŚÉýäť metoclopramideýÖÇ cisplatin ŰśÉŰŐö oxaliplatin Ű│ĹÝĽęý▓śŰŽČŕ░Ç ýäŞÝĆČýéČŰęŞýŁä ýťáŰĆäÝĽśŰŐöýžÇ ÝÖĽýŁŞÝĽśýśÇŰőĄ. ýáĽýâüýäŞÝĆČýŁŞ Ýśłŕ┤Çŕ░äýäŞÝĆČ(MC)ýÖÇ ýÜöýäŞŕ┤ÇýâüÝö╝ýäŞÝĆČ(TCMK-1)ýŚÉýäťŰŐö metoclopramideýÖÇ cisplatin ŰśÉŰŐö oxaliplatin Ű│ĹÝĽęý▓śŰŽČýŚÉŰĆä ýäŞÝĆČýŁś ÝśĽÝâťÝĽÖýáü Ű│ÇÝÖö Ű░Ć sub-G1ŕŞ░ýŁś ŰÂäÝĆČŰĆä ýŽŁŕ░ÇÝĽśýžÇ ýĽŐýĽśŰőĄ(Fig. 4A and B). ŰśÉÝĽť ŰĹÉ ýáĽýâüýäŞÝĆČýú╝(MCýÖÇ TCMK-1)ŰŐö AMC-HN4Ű│┤ŰőĄ ÝÖĽýŚ░ÝĽśŕ▓î Mcl-1ýŁ┤ Ű░ťÝśäýŁ┤ Űé«ŕŞ░ ŰĽîŰČŞýŚÉ metoclopramideýŚÉ ŰîÇÝĽť Ű░śýŁĹýä▒ýŁ┤ ýŚćýľ┤ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť Űé┤ýä▒ýŁ┤ ŰéśÝâÇŰéśŰŐö ŕ▓âýť╝Űíť ýéČŰúîŰÉťŰőĄ(Fig. 4C). ýŁ┤ ŕ▓░ŕ│╝Űą╝ ÝćÁÝĽ┤ metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś Ű│ĹÝĽę ý▓śŰŽČŰŐö ýĽöýäŞÝĆČýŚÉýäť ÝŐ╣ýŁ┤ýáüýť╝Űíť ýäŞÝĆČýéČŰęŞýŁä ýťáŰĆäÝĽśŰŐö ŕ▓âýŁä ýĽî ýłś ý׳ŰőĄ.
ŕ│á ý░░ŕĚŞŰĆÖýĽł ŰĹÉŕ▓ŻŰÂÇýĽöýŁś ý╣śŰúîŰą╝ ýťäÝĽ┤ ýłśýłáýáü ý╣śŰúîŕ░Ç ýäáÝśŞŰÉśýŚłýť╝Űéś ýłśýłá ÝŤä ŰéśÝâÇŰéśŰŐö ŰžÄýŁÇ ŕŞ░ŰŐą ý׹ýĽáýÖÇ ÝĽęŰ│ĹýŽŁ Űô▒ýť╝Űíť ýÁťŕĚ╝ýŚÉŰŐö ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓Ľ Ű░Ć Ű░ęýéČýäá ý╣śŰúîýŚÉ ŰîÇÝĽť ŕ┤ÇýőČýŁ┤ ŰćĺýĽäýžÇŕ│á ý׳ŰőĄ. ÝĽśýžÇŰžî ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓ĽýŁä ýŁ┤ýÜęÝĽť ýžÇýćŹýáüýŁŞ ý╣śŰúîŰŐö ÝÖśý×ÉýŚÉŕ▓î ŕĚ╣ýőČÝĽť ŕÁČÝćá Űô▒ ŰÂÇý×ĹýÜęýŁä ý┤łŰלݼśŕ│á ýĽäýÜŞŰčČ ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť ýáÇÝĽşýä▒ Ű░ťýâŁýŁä ÝćÁÝĽ┤ ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓ĽýŁś ÝÜĘŕ│╝Űą╝ ýáÇÝĽ┤ÝĽá ýłś ý׳ŰőĄ. Ű│Ş ýŚ░ŕÁČýŚÉýäťŰŐö ýŚČýáäÝ׳ ý×äýâüýŚÉýäť ÝĽşýĽö ý╣śŰúîýŚÉ Űö░ŰąŞ ŰÂÇý×ĹýÜę ý╣śŰúîŰą╝ ýťäÝĽ┤ ýéČýÜę ýĄĹýŁŞ ÝĽşŕÁČÝćáýáťýŁŞ metoclopramideýŁś platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś ÝĽşýĽö ÝÜĘŕ│╝ ýŽŁýžä ýŚČŰÂÇŰą╝ ÝÖĽýŁŞÝĽśýśÇŰőĄ. MetoclopramideýŁś ŰőĘŰĆů ý▓śŰŽČŰŐö ŰĹÉŕ▓ŻŰÂÇ ýĽöýäŞÝĆČýŁŞ AMCHN4ýŁś ýéČŰęŞýŁä ýťáŰĆäÝĽśýžÇ ýĽŐýžÇŰžî ýáÇŰćŹŰĆäýŁś cisplatin ŰśÉŰŐö oxaliplatinýŚÉ ýŁśÝĽť ýäŞÝĆČýéČŰęŞýŁä ÝÜĘŕ│╝ýáüýť╝Űíť ýŽŁýžäÝĽťŰőĄ. ŰśÉÝĽť metoclopramideŰŐö ýťáýŁ╝ÝĽśŕ▓î ÝĽşýäŞÝĆČýéČŰęŞ ŰőĘŰ░▒ýžłýŁŞ Mcl-1ýŁś Ű░ťÝśäýŁä ŕ░ÉýćîýőťÝéĄŰę░, ýŁ┤ŰŐö Ű▓łýŚş ÝŤä ŰőĘŕ│ä ýí░ýáłŰíť ÝöäŰíťÝůîýĽäýóÇ ÝÖťýä▒ýŁä ÝćÁÝĽť Mcl-1 ŰőĘŰ░▒ýžł ŰÂäÝĽ┤Űą╝ ýťáŰĆäÝĽťŰőĄ. ýáĽýâüýäŞÝĆČýŚÉýäťŰŐö metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽ┤ ýéČŰęŞýŁ┤ ýŁ╝ýľ┤ŰéśýžÇ ýĽŐýĽśŰőĄ. ýŁ┤ ŕ▓░ŕ│╝Űíť ŰĹÉŕ▓ŻŰÂÇýĽöýŚÉýäť metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś Ű│ĹýÜęý▓śŰŽČŰŐö ýĽöýäŞÝĆČýŚÉŰžî ý×ĹýÜęÝĽśýŚČ ýéČŰęŞ ýŽŁýžä ÝÜĘŕ│╝Űą╝ ýâüýŐ╣ýőťÝéČ ýłś ý׳ýŁîýŁä ÝÖĽýŁŞÝľłŰőĄ.
ŰĹÉŕ▓ŻŰÂÇýĽö ý╣śŰúîŰą╝ ýťäÝĽ┤ ýéČýÜęŰÉśŰŐö platinum ŕŞ░Ű░ś ÝĽşýĽöýáťŰŐö DNA ýćÉýâüýŁä ÝćÁÝĽ┤ ŰŤ░ýľ┤Űéť ÝĽşýĽöÝÜĘŕ│╝Űą╝ ŰéśÝâÇŰé┤ýžÇŰžî ýŁ┤ŰĆůýä▒ Ű░Ć ýőáý׹ŰĆůýä▒ŕ│╝ ŕ░ÖýŁÇ ŰÂÇý×ĹýÜęýŁä ý┤łŰלݼťŰőĄ[6,8]. ŰśÉÝĽť ýžÇýćŹýáüýŁŞ ý╣śŰúîŰéś ŕ│╝ýÜęŰčë ýéČýÜęýőť Ű░ťýâŁÝĽśŰŐö platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť Űé┤ýä▒ýŁä ŕ░ťýäáÝĽśŕŞ░ ýťäÝĽ┤ ÝâÇ ýĽŻŰČ╝ŕ│╝ Ű│ĹýÜę ýéČýÜęýőť ÝĽşýĽöÝÜĘŕ│╝ŕ░Ç ýŽŁýžäŰÉśŰŐöýžÇ ÝÖĽýŁŞÝĽśŰáĄŰŐö ýŚ░ŕÁČŕ░Ç ýŽŁŕ░ÇÝĽśŰŐö ýÂöýäŞŰőĄ[9]. ŰĹÉŕ▓ŻŰÂÇ ýĽöýäŞÝĆČŰŐö ÝĹťÝö╝ýä▒ý׹ýŁŞý×ÉýłśýÜęý▓┤(epidermal growth factor receptor, EGFR)ýŁś Ű░ťÝśäýŁ┤ ŰćĺýĽä ÝÖśý×ÉýŁś Űé«ýŁÇ ýâŁýí┤ýťĘýŁä ŰéśÝâÇŰéŞŰőĄ[17,18]. Űö░ŰŁ╝ýäť EGFRýŚÉ ŰŽČŕ░äŰôťýŁś ŰÂÇý░ęýŁä ŰžëŰŐö cetuximabýŁä ýŁ┤ýÜęÝĽśýŚČ EGFR ýőáÝśŞýáäŰőČ ŕ▓ŻŰíť ýáÇÝĽ┤Űą╝ ÝćÁÝĽť cisplatinýŚÉ ýŁśÝĽť Ű»╝ŕ░Éýä▒ ýŽŁýžäýŚÉ ŰîÇÝĽ┤ Ű│┤ŕ│áŰÉśýŚłŰőĄ[19,20]. ýÁťŕĚ╝ýŚÉŰŐö Űę┤ýŚşŕ┤ÇŰČŞýľÁýáťýáťýŁŞ nivolumab ŰśÉŰŐö pembrolizumabŰą╝ ýŁ┤ýÜęÝĽť platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ Ű»╝ŕ░Éýä▒ ýŽŁýžä ÝÜĘŕ│╝ýŚÉ ŰîÇÝĽť ýŚ░ŕÁČŕ░Ç ýžäÝľë ýĄĹýŁ┤ŰőĄ[21,22].
ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓ĽýŁś ŰîÇÝĹťýáüýŁŞ ŰÂÇý×ĹýÜęýŁŞ ŕÁČÝćáŰą╝ ýľÁýáťÝĽśŕŞ░ ýťäÝĽ┤ ýéČýÜęŰÉśŰŐö metoclopramideŰŐö ýĄĹýÂöýőáŕ▓Żŕ│äýŁś ŰĆäÝîîŰ»╝ ýłśýÜęý▓┤Űą╝ ý░ĘŰőĘÝĽá Ű┐ÉŰžî ýĽäŰőłŰŁ╝ ýâüŰÂÇ ýćîÝÖöŕ┤ÇýŁś ýĽäýäŞÝőŞýŻťŰŽ░ýŁś ÝÜĘŕ│╝ ýŽŁýžäýŁä ÝćÁÝĽ┤ ýťäý׹ ýÜ┤ŰĆÖýŁä ý┤ëýžäýőťý╝ť ýĽöÝÖśý×ÉýŚÉŕ▓î ŰéśÝâÇŰéśŰŐö ýćîÝÖöŰÂłŰčëŰĆä ŕ░ťýäáýőťÝéĘŰőĄŕ│á ýĽîŰáĄý᪠ý׳ŰőĄ[23]. ýÁťŕĚ╝ Ű│┤ŕ│áýŚÉ Űö░Űą┤Űę┤ ŕ│áŰćŹŰĆäýŁś metoclopramide (2 mM)ýŁś ý▓śŰŽČŰŐö ýé╝ýĄĹýŁîýä▒ýťáŰ░ęýĽö ýäŞÝĆČýŁś ýŽŁýőŁýŁä Űžëŕ│á ýäŞÝĆČýéČŰęŞýŁä ýťáŰĆäÝĽśŰę░, ÝĽşýäŞÝĆČýéČŰęŞ ŕŞ░ŰŐąýŁä ÝĽśŰŐö Bcl-2 ŰÂÇŰąś ŰőĘŰ░▒ýžłýŁŞ Mcl-1, Bcl-xL, Bcl-2 Ű░Ć Bcl-WýŁś Ű░ťÝśäýŁä ýľÁýáťÝĽťŰőĄ[16]. ýŁ┤ýáä Ű│┤ŕ│áŰą╝ ÝćÁÝĽ┤ ŰĹÉŕ▓ŻŰÂÇýĽö ýäŞÝĆČŰą╝ ýŁ┤ýÜęÝĽť ýŁ┤ýóůýŁ┤ýőŁ ŰĆÖŰČ╝۬ĘŰŹŞýŚÉýäť metoclopramideýŁś cisplatin ÝĽşýĽöÝÜĘŕ│╝ ýŽŁýžä ÝÜĘŕ│╝Űą╝ in vivo ŕ▓ÇýŽŁÝĽśýśÇýť╝Űéś ýáĽÝÖĽÝĽť ŰÂäý×Éýáü ŕŞ░ýáäýŚÉ ŰîÇÝĽť ýŚ░ŕÁČŰŐö ýžäÝľëŰÉśýžÇ ýĽŐýĽśŰőĄ[13]. Űö░ŰŁ╝ýäť Ű│Ş ýŚ░ŕÁČýŚÉýäťŰŐö ŰĹÉŕ▓ŻŰÂÇ ýĽöýäŞÝĆČýŁś ýéČŰęŞýŁ┤ ýťáŰĆäŰÉśýžÇ ýĽŐŰŐö ýáÇŰćŹŰĆäýŁś metoclopramide (0.25-1 mM)Űą╝ ýéČýÜęÝĽśýŚČ ÝĽşýĽöÝÜĘŕ│╝ ýŽŁýžäýŚÉ ŕ┤ÇŰáĘŰÉť ŰÂäý×Éýáü ŕŞ░ýáäýŁä ýí░ýéČÝĽśýśÇŕ│á ýťáýŁ╝ÝĽśŕ▓î Mcl-1ýŁś Ű░ťÝśäýŁ┤ ŕ░ÉýćîÝĽśýśÇŰőĄ.
Mcl-1ýŁÇ ŰîÇÝĹťýáüýŁŞ ÝĽşýäŞÝĆČýéČŰęŞ ŕŞ░ŰŐąýŁä ŕ░Çýžä Bcl-2 ŰÂÇŰąś ŰőĘŰ░▒ýžł ýĄĹ ÝĽśŰéśŰíť Mcl-1ýŁś Ű░ťÝśä ýŁ┤ýâüýŁÇ ŰőĄýľĹÝĽť ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť Ű»╝ŕ░Éýä▒ýŁä ýŽŁýžäýőťÝéĄŕ│á ŰžÄýŁÇ ýĽöýäŞÝĆČýŁś ýéČŰęŞýŁä ýťáŰĆäÝĽťŰőĄ[24]. Mcl-1ýŁś Ű░ťÝśäýŁÇ ýáäýéČ Ű░Ć Ű▓łýŚş ÝŤä ŰőĘŕ│äŰą╝ ÝćÁÝĽ┤ ýí░ýáłŰÉśŰę░, metoclopramideýŁÇ Mcl-1ýŁś mRNA Ű░ťÝśäýŚÉŰŐö Ű│ÇÝÖöŕ░Ç ýŚćŕŞ░ ŰĽîŰČŞýŚÉ Ű▓łýŚş ÝŤä ŰőĘŕ│ä ýí░ýáłýŁä ÝćÁÝĽ┤ Ű░ťÝśäýŁ┤ ŕ░ÉýćîÝĽĘýŁä ýĽî ýłś ý׳ŰőĄ[25]. ŰőĘŰ░▒ýžłýŁÇ ýťáŰ╣äÝÇ┤Ýő┤-ÝöäŰíťÝůîýĽäýóÇ ýőťýŐĄÝůťýŁä ÝćÁÝĽ┤ ŰÂäÝĽ┤ŰÉĘýť╝ŰíťýŹĘ ÝĽşýâüýä▒ ýťáýžÇŰą╝ ÝćÁÝĽ┤ ŰőĄýľĹÝĽť ýőáÝśŞýáäŰőČ ŕ▓ŻŰíťŰą╝ ýí░ýáłÝĽá ýłś ý׳ŰőĄ[26]. ŰĹÉŕ▓ŻŰÂÇ ýĽöýäŞÝĆČýŚÉýäť metoclopramideýŚÉ ýŁśÝĽť Mcl-1ýŁś ŰőĘŰ░▒ýžł Ű░ťÝśä ŕ░ÉýćîŰŐö ÝöäŰíťÝůîýĽäýóÇ ýáÇÝĽ┤ýáťýŁŞ MG132ýŚÉ ýŁśÝĽ┤ ýÖäŰ▓ŻÝĽśŕ▓î ýľÁýáťŰɜۻÇŰíť ýťáŰ╣äÝÇ┤Ýő┤-ÝöäŰíťÝůîýĽäýóÇ ýőťýŐĄÝůťýŁä ÝćÁÝĽť Mcl-1 ŰőĘŰ░▒ýžł ŰÂäÝĽ┤Űą╝ ýśłýŞíÝĽá ýłś ý׳ŰőĄ. ŰžÄýŁÇ ýŚ░ŕÁČŰą╝ ÝćÁÝĽśýŚČ Mcl-1ýŁś ŰőĘŰ░▒ýžł ýĽłýáĽýä▒ ýí░ýáłÝĽśŰŐö E3 ŰŽČŕ░ÇýĽäýáťýÖÇ ÝâłýťáŰ╣äÝÇ┤Ýő┤ÝÖöÝÜĘýćî(deubiquitinase)ŕ░Ç ýĽîŰáĄý᪠ý׳ýť╝Űę░, ýÂöÝŤä metoclopramideýŚÉ ýŁśÝĽť Mcl-1ýŁś ŰőĘŰ░▒ýžł ŰÂäÝĽ┤ ŕŞ░ýáäýŚÉ ŰîÇÝĽť ŰŹö ŕ╣ŐýŁ┤ ý׳ŰŐö ýŚ░ŕÁČŕ░Ç ÝĽäýÜöÝĽśŰőĄ[27,28].
ýéČŰęŞýŁś ÝĽť ýóůŰąśýŁŞ ýĽäÝĆČÝćáýőťýŐĄ(apoptosis)ŰŐö ýâŁý▓┤ Űé┤ ÝĽşýâüýä▒ ýťáýžÇýŚÉ ÝĽäýłśýáüýŁŞ ŕ│╝ýáĽýť╝Űíť ýŁ┤ýâüýŁ┤ Ű░ťýâŁÝĽśŰę┤ ýóůýľĹ ÝśĽýä▒ Ű░Ć ÝĽşýĽöýáť Űé┤ýä▒ýŁä ýťáŰ░ťÝĽťŰőĄ[29]. ýĽäÝĆČÝćáýőťýŐĄŰŐö caspaseýŁś ÝÖťýä▒ÝÖöýŚÉ ýŁśÝĽ┤ DNA ŕ┤ÇŰáĘ ýťáýáäý×É Ű░Ć PARP Űô▒ýŁś ŰőĘŰ░▒ýžłýŁś ŰÂäýáłýŁä ÝćÁÝĽ┤ ýťáŰĆäŰÉťŰőĄ[30]. ŰĹÉŕ▓ŻŰÂÇ ýĽöýäŞÝĆČýŚÉýäť metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýÖÇ Ű│ĹÝĽęý▓śŰŽČýŚÉ ýŁśÝĽ┤ ýťáŰĆäŰÉśŰŐö ýéČŰęŞýŁ┤ ýáäÝśĽýáüýŁŞ ýĽäÝĆČÝćáýőťýŐĄýŁŞýžÇ ÝÖĽýŁŞÝĽśŕŞ░ ýťäÝĽ┤ýäť caspase ýáÇÝĽ┤ýáťŰą╝ ýŁ┤ýÜęÝĽśýŚČ sub-G1ŕŞ░ýŁś ýäŞÝĆČ Ű╣äýťĘ Ű░Ć PARPýŁś ýáłŰőĘýŁä Ű╣äŕÁÉÝĽśýśÇŰőĄ. MetoclopramideýÖÇ cisplatin ŰśÉŰŐö oxaliplatin Ű│ĹÝĽę ý▓śŰŽČýŚÉ ýŁśÝĽ┤ ýŽŁŕ░ÇŰÉť sub-G1ŕŞ░ýÖÇ PARP ýáłŰőĘýŁÇ caspase ýáÇÝĽ┤ýáťýŚÉ ýŁśÝĽ┤ ýÖäŰ▓ŻÝ׳ ýľÁýáťŰÉśýŚłŰőĄ. ýŁ┤ ŕ▓░ŕ│╝Űíť metoclopramideŕ░Ç caspase ýŁśýí┤ýáü ýĽäÝĆČÝćáýőťýŐĄŰą╝ ýŽŁŕ░Çýőťý╝ť platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŚÉ ŰîÇÝĽť Ű»╝ŕ░ÉŰĆäŰą╝ ýŽŁŕ░ÇýőťÝéĄŰŐö ŕ▓âýŁä ýĽî ýłś ý׳ŰőĄ.
Ű│Ş ýŚ░ŕÁČýŚÉýäť ŕ▓ÇýŽŁÝĽť metoclopramideýÖÇ platinum ŕŞ░Ű░ś ÝĽşýĽöýáťýŁś Ű│ĹÝĽę ý╣śŰúîŰ▓ĽýŁÇ ýáĽýâü ýäŞÝĆČýŚÉýäťŰŐö ýśüÝľąýŁä ýú╝ýžÇ ýĽŐŕ│á ýĽöýäŞÝĆČýŚÉýäť ÝŐ╣ýŁ┤ýáüýť╝Űíť ý×ĹýÜęÝĽśŰ»ÇŰíť ŰÂÇý×ĹýÜęýŁä ýĄäýŁ╝ ýłś ý׳ŰőĄŰŐö ŕ░ĽýáÉýŁ┤ ý׳ýť╝Űę░, metoclopramideŕ░Ç ŰĹÉŕ▓ŻŰÂÇ ýĽö ý╣śŰúî ýśüýŚşýŚÉýäť ŕŞ░ýí┤ ÝĽşýĽö ÝÖöÝĽÖ ýÜöŰ▓ĽýŁś ÝÜĘýťĘýä▒ýŁä ýŽŁýžäýőťÝéČ ýłś ý׳ŰŐö ŕ░ÇŰŐąýä▒ýŁä ýáťýőťÝĽťŰőĄ.
Supplementary MaterialThe Data Supplement is available with this article at https://doi.org/10.3342/kjorl-hns.2023.00962.
Supplementary Fig. 1. Effect of metoclopramide on viability and apoptosis in head and neck cancer cells. A: AMC-HN4 and AMC-HN6 cells were treated with 0.1ÔÇô5 mM metoclopramide for 24 h. Cell viability were measured by XTT assay. B: AMC-HN4 cells were treated with 0.1ÔÇô5 mM metoclopramide for 24 h. Cell death was determined by Annexin V staining. The values in the graphs (A and B) represent the mean┬▒standard deviation of three independent experiments. *p<0.01 compared to control.
kjorl-hns-2023-00962-Supplementary-Fig-1.pdf
Supplementary Fig. 2. Involvement of Mcl-1 in combined treatment with metoclopramide and platinum-based drugs-induced apoptosis. AMC-HN4 cells were treated with 0.5 mM metoclopramide or/and 30 ╬╝M platinum-based drugs (cisplatin and oxaliplatin) for 24 h. The sub-G1 population (A) and protein expression (B) were determined using flow cytometry and western blotting, respectively. *p<0.01 compared to control.
kjorl-hns-2023-00962-Supplementary-Fig-2.pdf
ACKNOWLEDGMENTSThis research was supported by a grant of the MD-Phd/Medical Scientist training program through the Korean Health Industry Development Institute (KHIDI), funded by the Ministry of health & Welfare, Republic of Korea.
NotesAuthor contributions Conceptualization: Jong Won Park, Seon Min Woo, Taeg Kyu Kwon. Data curation: Jong In Jeong, Jae Man Lee, Ji Won Lee. Funding acquisition: Taeg Kyu Kwon. Investigation: Jong Won Park, Seon Min Woo. Supervision: Dong Eun Kim, Taeg Kyu Kwon. WritingÔÇöoriginal draft: Jong Won Park, Seon Min Woo, Dong Eun Kim, Taeg Kyu Kwon. WritingÔÇöreview & editing: Jong Won Park, Seon Min Woo, Dong Eun Kim, Taeg Kyu Kwon. Fig.┬á1.Metoclopramide enhances platinum-based drugs-induced apoptosis in AMC-HN4 cells. A-C: AMC-HN4 cells were treated with 0.5 mM metoclopramide or/and 30 ╬╝M platinum-based drugs (cisplatin and oxaliplatin) for 24 h. The sub-G1 population and protein expression were determined using flow cytometry and western blotting, respectively (A). DNA fragmentation was analyzed using DAPI staining and kit (B). Measurement of DEVDase (caspase-3) activity using substrate (C). D: AMC-HN4 cells were treated with combination of 0.5 mM metoclopramide and 30 ╬╝M platinum-based drugs (cisplatin and oxaliplatin) after pretreatment with 20 ╬╝M zVAD and for 24 h. Values in the graphs represent the mean┬▒standard deviation of three independent experiments. *p<0.05 compared to the control; ÔÇáp<0.05 compared to combinations of metoclopramide and platinum-based drugs. 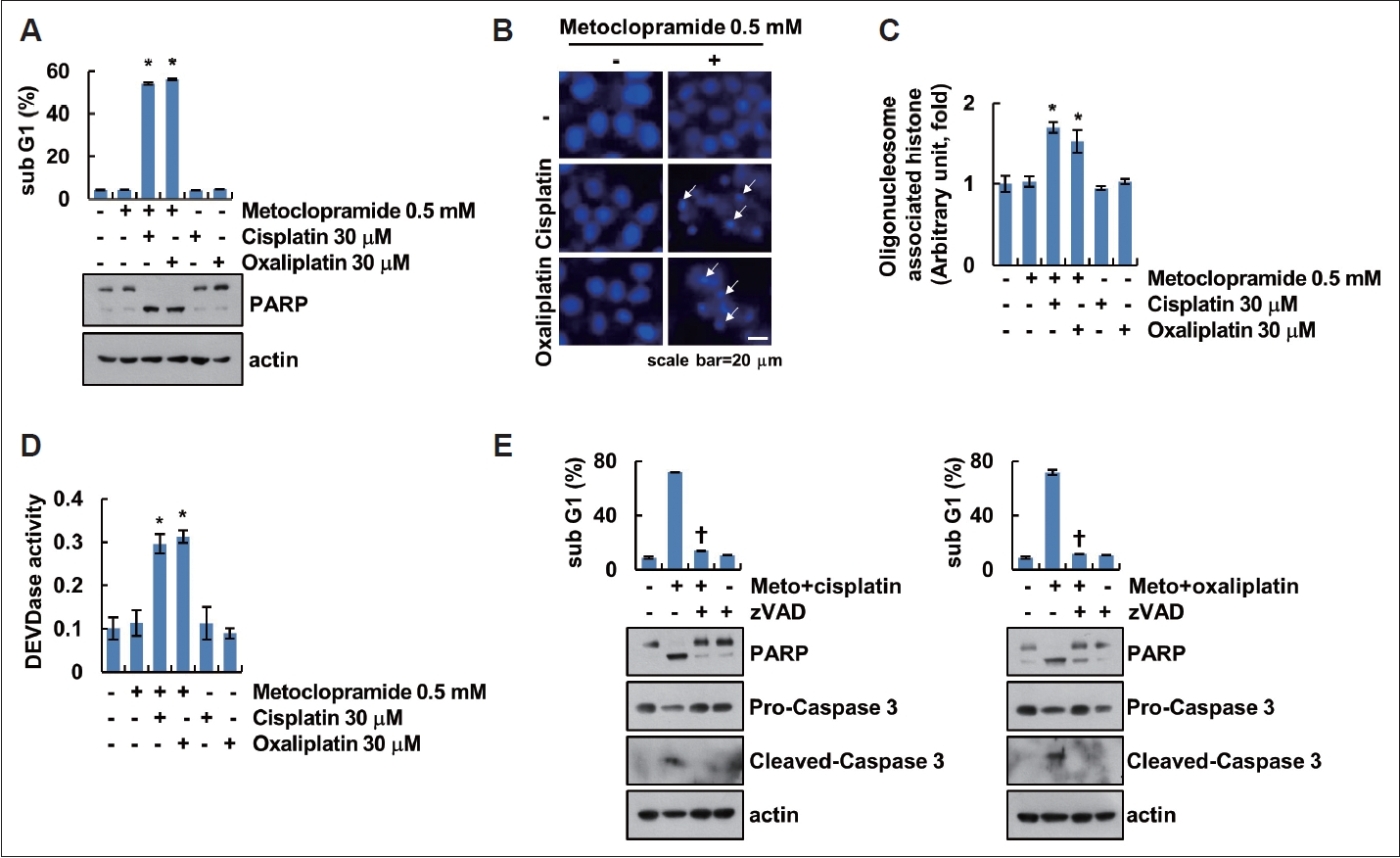
Fig.┬á2.Downregulation of Mcl-1 by metoclopramide is involved in platinum-based drugs-mediated apoptosis in AMC-HN4 cells. A: AMCHN4 and AMC-HN6 cells were treated with 0.2ÔÇô1 mM metoclopramide for 24 h. B: AMC-HN4 were transfected with vector and Mcl-1 plasmid, and then treated with combinations of 1 mM metoclopramide and 30 ╬╝M platinum-based drugs (cisplatin and oxaliplatin) for 24 h. The sub-G1 population and protein expression were determined using flow cytometry and western blotting, respectively. Values in the graphs (B) represent the mean┬▒standard deviation of three independent experiments. *p<0.01 compared to combinations of 1 mM metoclopramide and 30 ╬╝M platinum-based drugs. 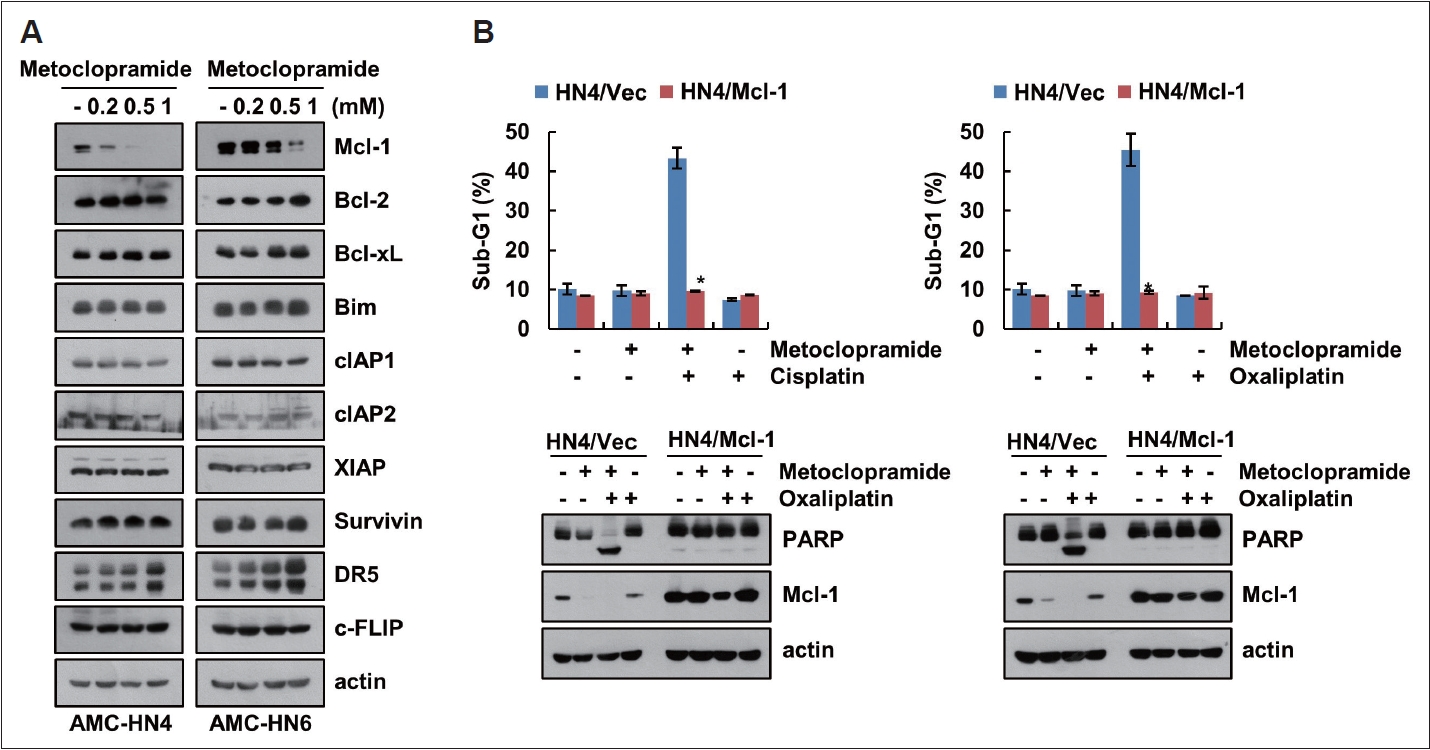
Fig.┬á3.Metoclopramide induces downregulation of Mcl-1 at the post-translational level. A: AMC-HN4 cells were treated with 0.2ÔÇô1 mM metoclopramide for 24 h. B: AMC-HN4 cells were treated with 0.5 mM metoclopramide after pretreatment with 20 ╬╝g/mL cycloheximide (CHX) for the diverse times. C: AMC-HN4 cells were treated with 0.5 mM metoclopramide after pretreatment with 0.25 ╬╝M MG132 or 2.5 ╬╝M lactacystin for 24 h. The protein expression was detected using western blotting. Values in the graph represent the mean┬▒standard deviation of three independent samples. 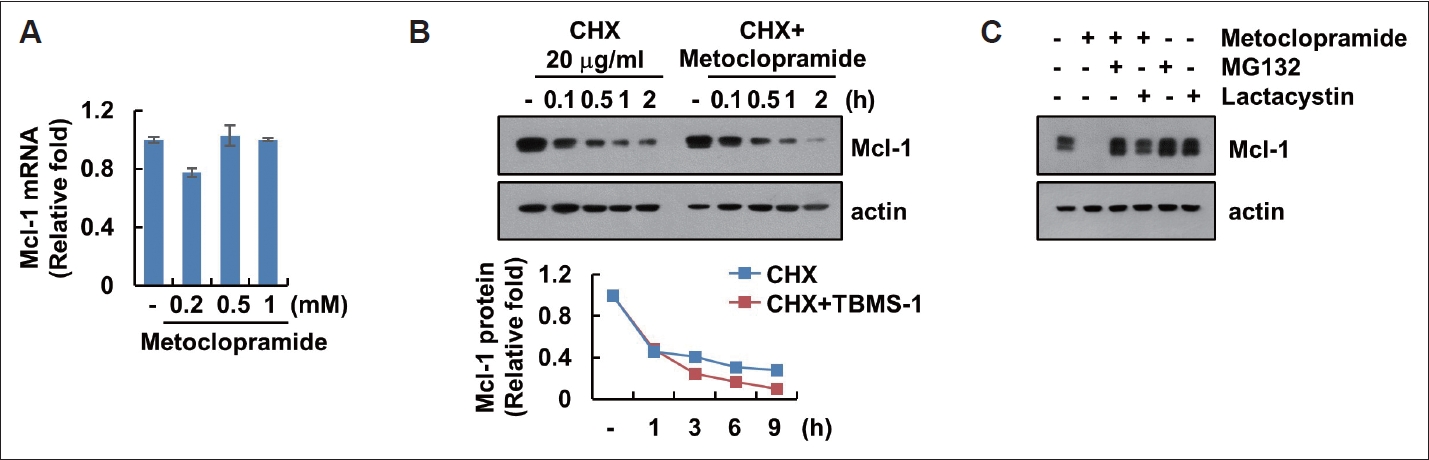
Fig.┬á4.Effect of combined treatment with metoclopramide and platinum-based drugs on apoptosis in normal cells. A and B: AMC-HN4 and normal cells (mesangial cell [MC], and kidney epithelial cell [TCMK-1]) cells were treated with 0.5 mM metoclopramide or/and 30 ╬╝M platinum-based drugs (cisplatin and oxaliplatin) for 24 h (A) or 48 h (B). Cell morphology was assessed using a microscope. Scale bar: 50 ╬╝m. The sub-G1 population was determined using flow cytometry. C: TCKM-1, MC, and AMC-HN4 cells were treated with 0.2ÔÇô1 mM metoclopramide for 24 h. The protein expression was detected using western blotting. Values in the graph represent the mean┬▒standard deviation of three independent samples. 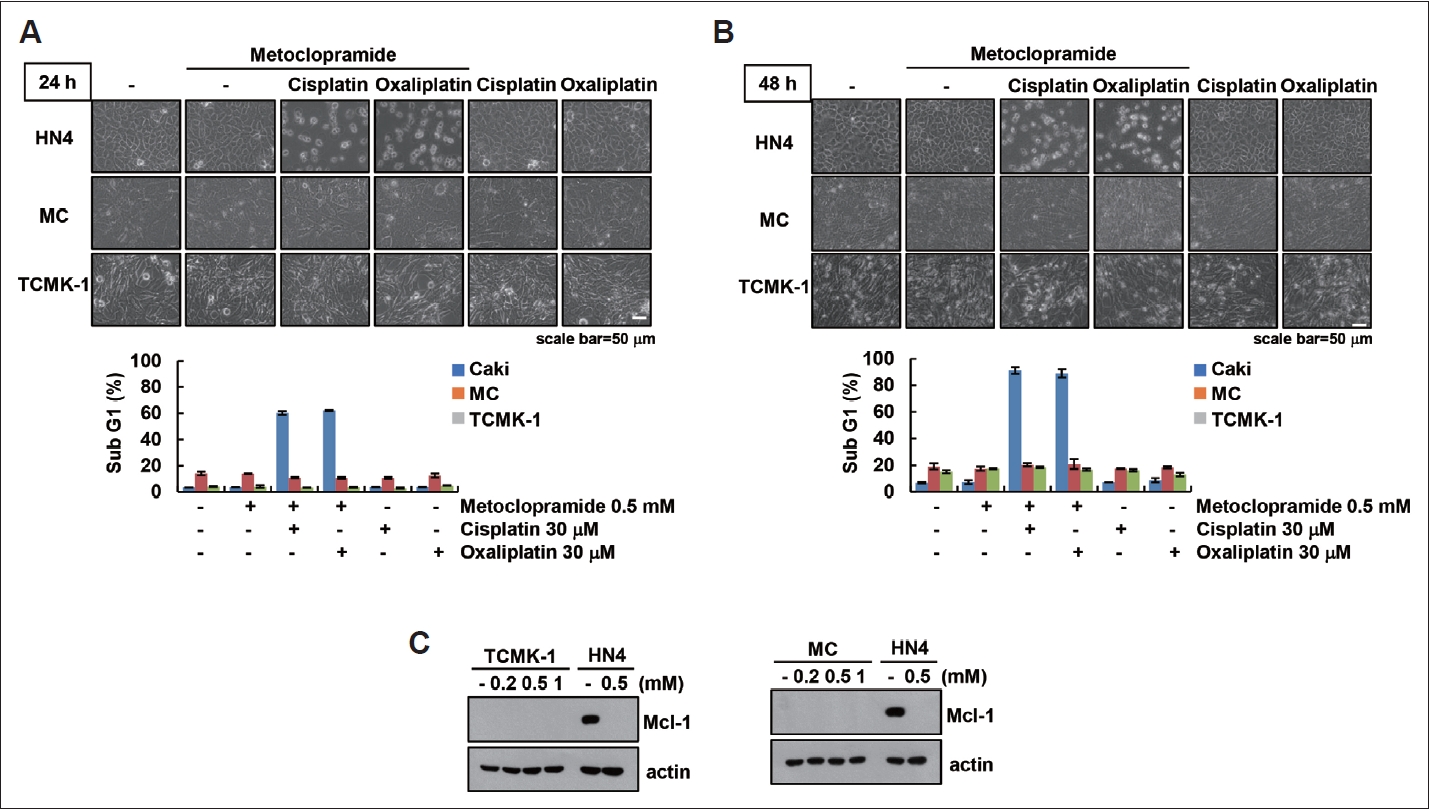
REFERENCES1. Simard EP, Torre LA, Jemal A. International trends in head and neck cancer incidence rates: differences by country, sex and anatomic site. Oral Oncol 2014;50(5):387-403.
2. Sroussi HY, Epstein JB, Bensadoun RJ, Saunders DP, Lalla RV, Migliorati CA, et al. Common oral complications of head and neck cancer radiation therapy: mucositis, infections, saliva change, fibrosis, sensory dysfunctions, dental caries, periodontal disease, and osteoradionecrosis. Cancer Med 2017;6(12):2918-31.
3. Nwizu T, Ghi MG, Cohen EE, Paccagnella A. The role of chemotherapy in locally advanced head and neck squamous cell carcinoma. Semin Radiat Oncol 2012;22(3):198-206.
4. Pfister DG, Ang KK, Brizel DM, Burtness BA, Busse PM, Caudell JJ, et al. Head and neck cancers, version 2.2013. Featured updates to the NCCN guidelines. J Natl Compr Canc Netw 2013;11(8):917-23.
5. Jung Y, Lippard SJ. Direct cellular responses to platinum-induced DNA damage. Chem Rev 2007;107(5):1387-407.
6. Rottenberg S, Disler C, Perego P. The rediscovery of platinum-based cancer therapy. Nat Rev Cancer 2021;21(1):37-50.
7. Zhou J, Kang Y, Chen L, Wang H, Liu J, Zeng S, et al. The drug-resistance mechanisms of five platinum-based antitumor agents. Front Pharmacol 2020;11:343.
8. Cooley ME, Davis L, Abrahm J. Cisplatin: a clinical review. Part IIÔÇônursing assessment and management of side effects of cisplatin. Cancer Nurs 1994;17(4):283-93.
9. Dilruba S, Kalayda GV. Platinum-based drugs: past, present and future. Cancer Chemother Pharmacol 2016;77(6):1103-24.
10. Wheate NJ, Walker S, Craig GE, Oun R. The status of platinum anticancer drugs in the clinic and in clinical trials. Dalton Trans 2010;39(35):8113-27.
11. Treat J, Schiller J, Quoix E, Mauer A, Edelman M, Modiano M, et al. ZD0473 treatment in lung cancer: an overview of the clinical trial results. Eur J Cancer 2002;38(Suppl 8):S13-8.
12. Berger MJ, Ettinger DS, Aston J, Barbour S, Bergsbaken J, Bierman PJ, et al. NCCN guidelines insights: antiemesis, version 2.2017. J Natl Compr Canc Netw 2017;15(7):883-93.
13. Kjell├ęn E, Wennerberg J, Pero R. Metoclopramide enhances the effect of cisplatin on xenografted squamous cell carcinoma of the head and neck. Br J Cancer 1989;59(2):247-50.
14. Anvari K, Seilanian-Toussi M, Hosseinzad-Ashkiki H, Shahidsales S. A comparison of 5-HT3 receptor antagonist and metoclopramide in the patients receiving chemotherapeutic regimens including CMF, CAF and CHOP. Iran J Cancer Prev 2015;8(2):84-8.
15. Weissenrieder JS, Neighbors JD, Mailman RB, Hohl RJ. Cancer and the dopamine D2 receptor: a pharmacological perspective. J Pharmacol Exp Ther 2019;370(1):111-26.
16. Chen Y, Zhang M, Ji X, Zhao J, Qin S, Ji Y, et al. The anti-cancer effect of metoclopramide on triple-negative breast cancer cells. Pharmazie 2021;76(4):172-4.
17. Rubin Grandis J, Melhem MF, Gooding WE, Day R, Holst VA, Wagener MM, et al. Levels of TGF-alpha and EGFR protein in head and neck squamous cell carcinoma and patient survival. J Natl Cancer Inst 1998;90(11):824-32.
18. Temam S, Kawaguchi H, El-Naggar AK, Jelinek J, Tang H, Liu DD, et al. Epidermal growth factor receptor copy number alterations correlate with poor clinical outcome in patients with head and neck squamous cancer. J Clin Oncol 2007;25(16):2164-70.
19. Fan Z, Baselga J, Masui H, Mendelsohn J. Antitumor effect of antiepidermal growth factor receptor monoclonal antibodies plus cisdiamminedichloroplatinum on well established A431 cell xenografts. Cancer Res 1993;53(19):4637-42.
20. Vermorken JB, Mesia R, Rivera F, Remenar E, Kawecki A, Rottey S, et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008;359(11):1116-27.
21. Okamoto I, Tsukahara K, Sato H. Single-center prospective study on the efficacy of nivolumab against platinum-sensitive recurrent or metastatic head and neck squamous cell carcinoma. Sci Rep 2022;12(1):2025.
22. Yamashita G, Okamoto I, Ito T, Tokashiki K, Okada T, Tsukahara K. Efficacy of nivolumab and pembrolizumab in platinum-sensitive recurrent or metastatic head and neck squamous cell carcinoma. Anticancer Res 2023;43(8):3679-83.
23. Lee A, Kuo B. Metoclopramide in the treatment of diabetic gastroparesis. Expert Rev Endocrinol Metab 2010;5(5):653-62.
24. Wang H, Guo M, Wei H, Chen Y. Targeting MCL-1 in cancer: current status and perspectives. J Hematol Oncol 2021;14(1):67.
25. Senichkin VV, Streletskaia AY, Gorbunova AS, Zhivotovsky B, Kopeina GS. Saga of Mcl-1: regulation from transcription to degradation. Cell Death Differ 2020;27(2):405-19.
26. Grabbe C, Husnjak K, Dikic I. The spatial and temporal organization of ubiquitin networks. Nat Rev Mol Cell Biol 2011;12(5):295-307.
27. Wu X, Luo Q, Liu Z. Ubiquitination and deubiquitination of MCL1 in cancer: deciphering chemoresistance mechanisms and providing potential therapeutic options. Cell Death Dis 2020;11(7):556.
|
|
||||||||||||||||||||||||||||||||||||||||||

 |
 |