안면신경 마비로 발현된 두개경화 동반 선상골병증 1예
A Case of Osteopathia Striata With Cranial Sclerosis Presenting as Facial Palsy
Article information
Trans Abstract
Osteopathia striata with cranial sclerosis (OSCS) is a rare genetic disorder characterized by skeletal abnormalities, cranial sclerosis, and various associated features. In this case report, we present the case of a patient with OSCS who complained of unilateral facial palsy. We discuss the clinical presentation, radiological findings, and genetic analysis, highlighting the importance of early diagnosis and multidisciplinary management in these cases.
서 론
두개경화 동반 선상골병증(osteopathia striata with cranial sclerosis, OSCS)은 극히 드문 유전성 질병으로 골격과 두개골 이상이 특징적이며, 장골의 가로 줄무늬 형태의 이상과 두개골의 경화로 나타난다[1]. 두개골 경화는 두개골의 밀집되고 뇌 및 안구 주변 구조에 압박을 줄 수 있으며 대두증, 전두부 돌출, 양안격리, 낮은 비근부, 그리고 구개열 등이 나타날 수 있다[2]. 국내에서는 3예가 보고된 바 있으나[3,4], 본 증례는 OSCS로 인해 발생한 안면 마비를 주소로 치험한 국내 첫 번째 사례로 초기 진단과 다학제적 관리의 중요성에 대해 논의하고자 한다. 본 연구는 환자 증례 보고로 생명의학연구윤리 심의위원회(Institutional Review Board)로부터 심사면제 받아 진행되었다(2023-10-049).
증 례
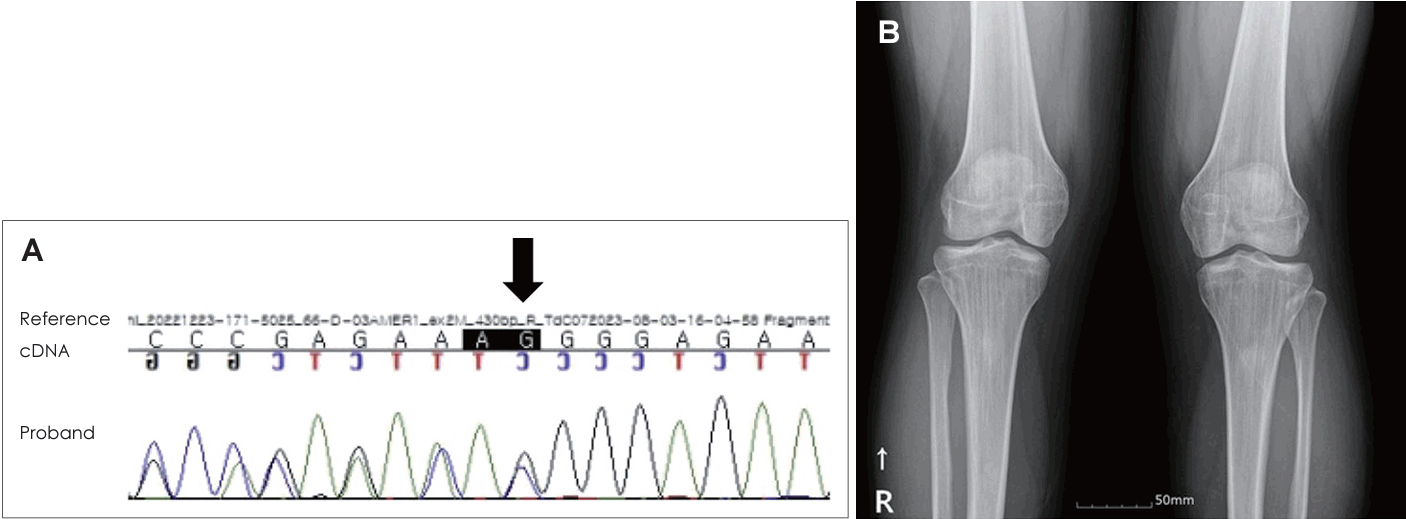
21세 여자 환자가 3일 전부터 발생한 우측 안면 마비로 외래를 방문했다. 7일 전 우측 안면 부위가 붓는 느낌이었다고하며 과거력상 1세 때 구개열 수술, 7세경 2차례 양측 삼출성 중이염으로 환기관 삽입술을 시행 받았다. 진찰상 양측 외이도는 다소 좁았고 양측 고막은 천공은 없으나 중앙부위는 얇았고 주변부에는 고실경화편이 넓게 위치해 있었다(Fig. 1A and B). 외견상 전체적으로 두부가 크고 전두부는 돌출되었으며, 양안격리의 소견이었으며 비근부는 다소 낮았다. 우측 안면 마비로 정지시 안면부 비대칭 소견, 이마는 주름을 지을 수 없었으며 눈은 최대의 노력에도 감기지 않았고, 입은 노력시에 약한 움직임을 보여 House-Brackmann (HB) grade V였다. 안면부 사진은 환자가 거부했다. 순음청력검사상 기도 골도차이(air-bone gap)가 우측 7.5 dB 및 좌측 8.6 dB이고 양측 기도청력역치 28 dB로 혼합성 난청소견이었고, 어음명료도는 양측 100%로 정상이었다(Fig. 1C). 컴퓨터단층촬영(CT)상 이하선 부위는 정상이었고 두개골과 유양돌기는 전반적으로 두껍고 경화된 모습이었다(Fig. 2A and B). 신경전도검사(electroneuronography)에서 우측은 좌측에 비해 안륜근에서 30.8% 및 구륜근에서 6.7%의 진폭이었다(Fig. 2C). 각막병변 유무를 판단하기 위해 시행한 안과협진상 시력이 우안 0.5 및 좌안 1.0이고 시야검사 등은 정상이었다. 비후된 두개골로 소아내분비과 협진상 골대사 호르몬 검사상 범위였다. 우측 벨씨 마비로 추정되어 입원 후 경구 prednisolone 60 mg (Solondo; YuHan Corp., Seoul, Korea)을 7일간 복용 및 물리치료를 시행하고 약물은 퇴원 후까지 감량을 시행했다. 안면신경감압술 등 수술적 치료 방법을 설명했으나 동의하지 않았다. 퇴원 후 6개월째 안면 마비가 지속되어 조영제 증강 뇌간 자기공명영상을 시행해 내이도와 소뇌교각 부위는 정상 소견이었고 양측 유양돌기는 비후되어 있었고 두개골이 전반적으로 두꺼워져 있었으며, 단순 뇌하수체 비대소견이 발견되었다(Fig. 3). 퇴원 후 안과에서 우측 안검하수에 대해 3차례 수술을 시행받았고 퇴원 79개월 뒤 재발성 좌측 중이염으로 다시 이비인후과를 방문했다. 과거 소견 외에 좌측 중이공간 중 약 20%에 삼출액이 관찰되었고 우측 안면 마비는 HB grade III였다(Fig. 4A and B). 외래에 동행한 환자의 어머니가 환자와 비슷한 안면모습이었고 문진상 사망한 외조모도 생존시에 비슷했다고 진술했다. 청력검사상 혼합성 난청이 지속되었고 고실도 검사상 우측 As형 및 좌측 C형이었다(Fig. 4C and D). 좌측 환기관 삽입술을 시행하고 골격계 유전성 질환을 의심하여 소아청소년과 협진으로 골격이형성증 유전자 패널(hereditaty skeletal dyaplasia panel) 검사를 시행하였다. 패널 분석 결과 AMER1 유전자의 NM_152424.4:c.867_868del (NP_689637.3:p.Lys292GlyfsTer31) 병적 변이가 발견되어 직접 시퀀싱으로 확인하였으며(Fig. 5A), 단순 방사선 검사상 장골과 골반의 특징적인 수직 줄무늬 모양(Fig. 5B)을 통해 선조성골병증-두개경화증(OSCS)으로 진단하였다. 환자 외의 다른 가족에서 유전자 검사는 원하지 않아서 시행하지 못했고 추가 검사상 양측 대뇌 혈관 이상 및 수두중이 발견되어 신경외과에서 주기적으로 관찰 중이다.
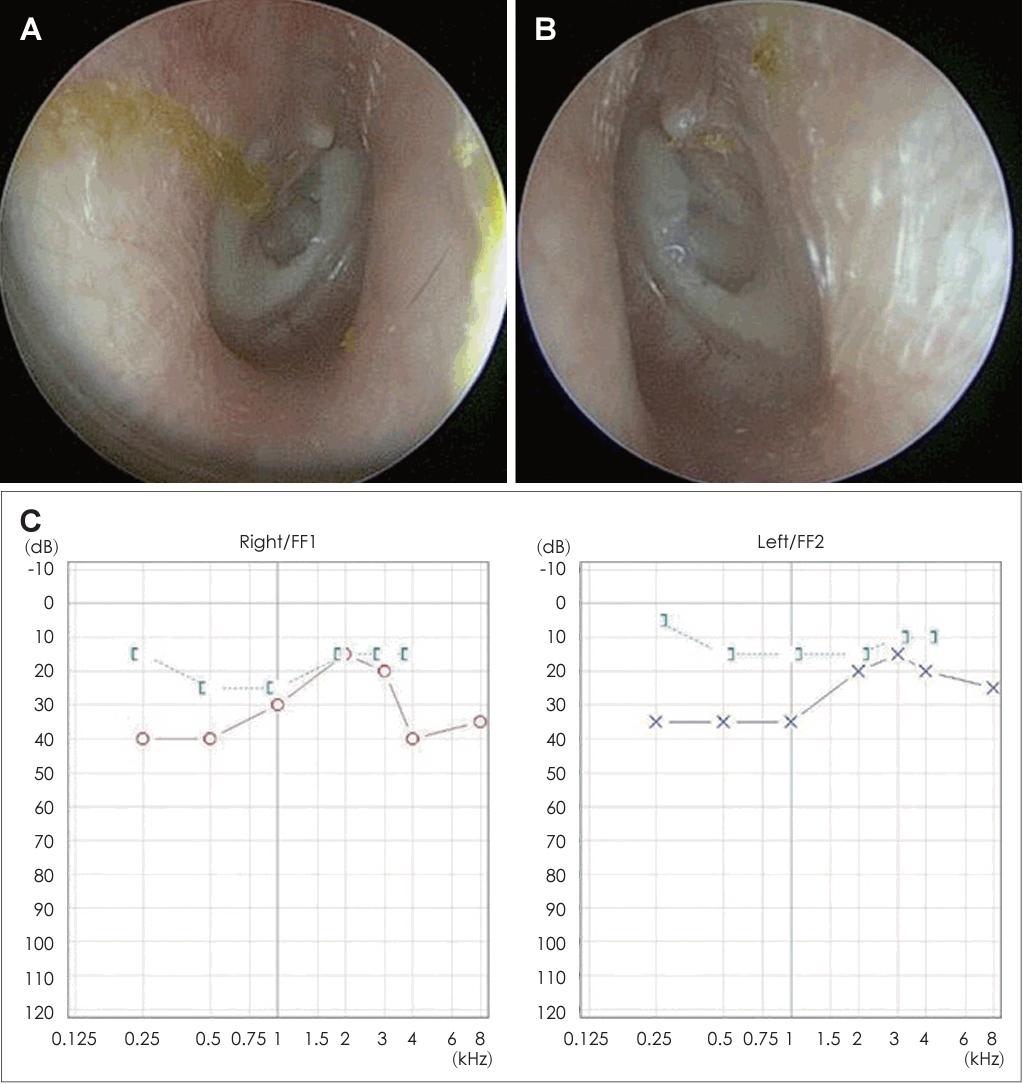
Both external auditory canal is mildly narrow and both tympanic membrane show central thin appearance with marginal diffuse sclerotic plaques (A: right, B: left). Pure tone audiogram shows mild hearing loss with some air-bone gaps in both ears (C).
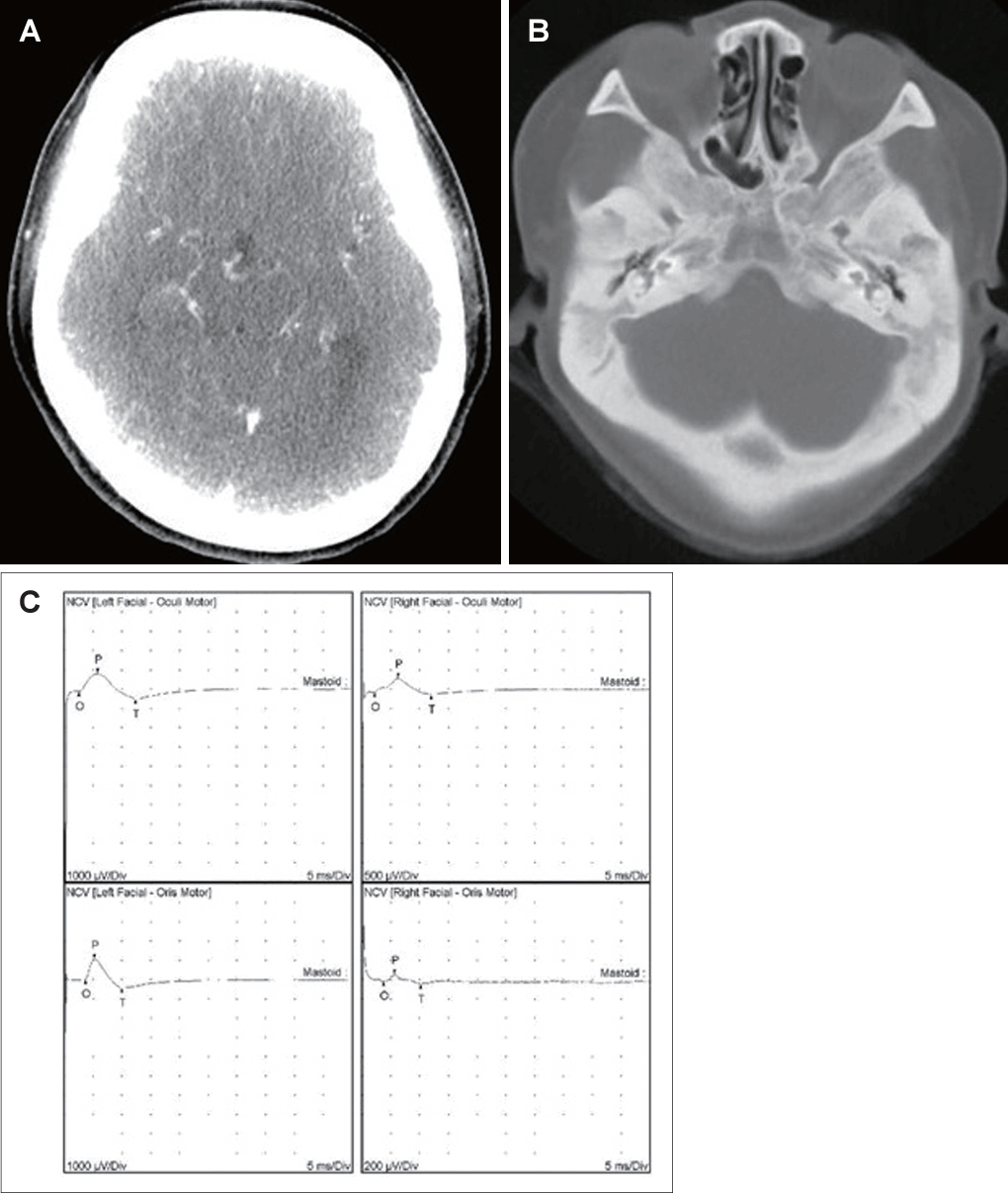
Neck computed tomogram with contrast enhancement shows diffuse, sclerotic, and thickened skull with contracted mastoid cavities in contrast-enhanced section (A) and bone setting (B). Electroneuronography shows that the amplitude of action potential of right orbicularis oculi is 30.8% compared to left side and that of right orbicularis oris is 6.7% compared to left side (C).
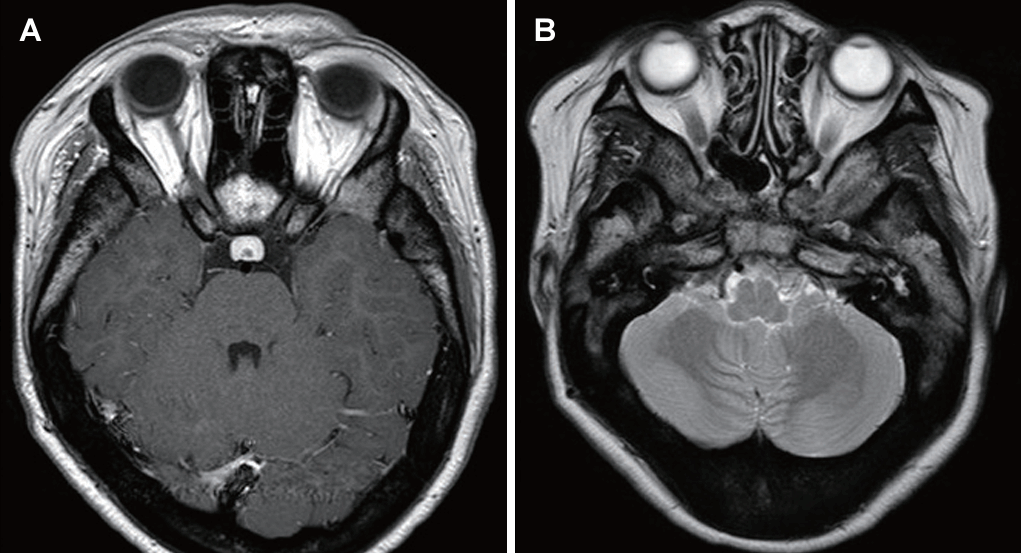
Brain stem magnetic resonance imaging shows pituitary hyperplasia and diffusely thickened skull and mastoid haziness in axial contrast-enhanced T1 scan (A) and axial T2 scan (B).
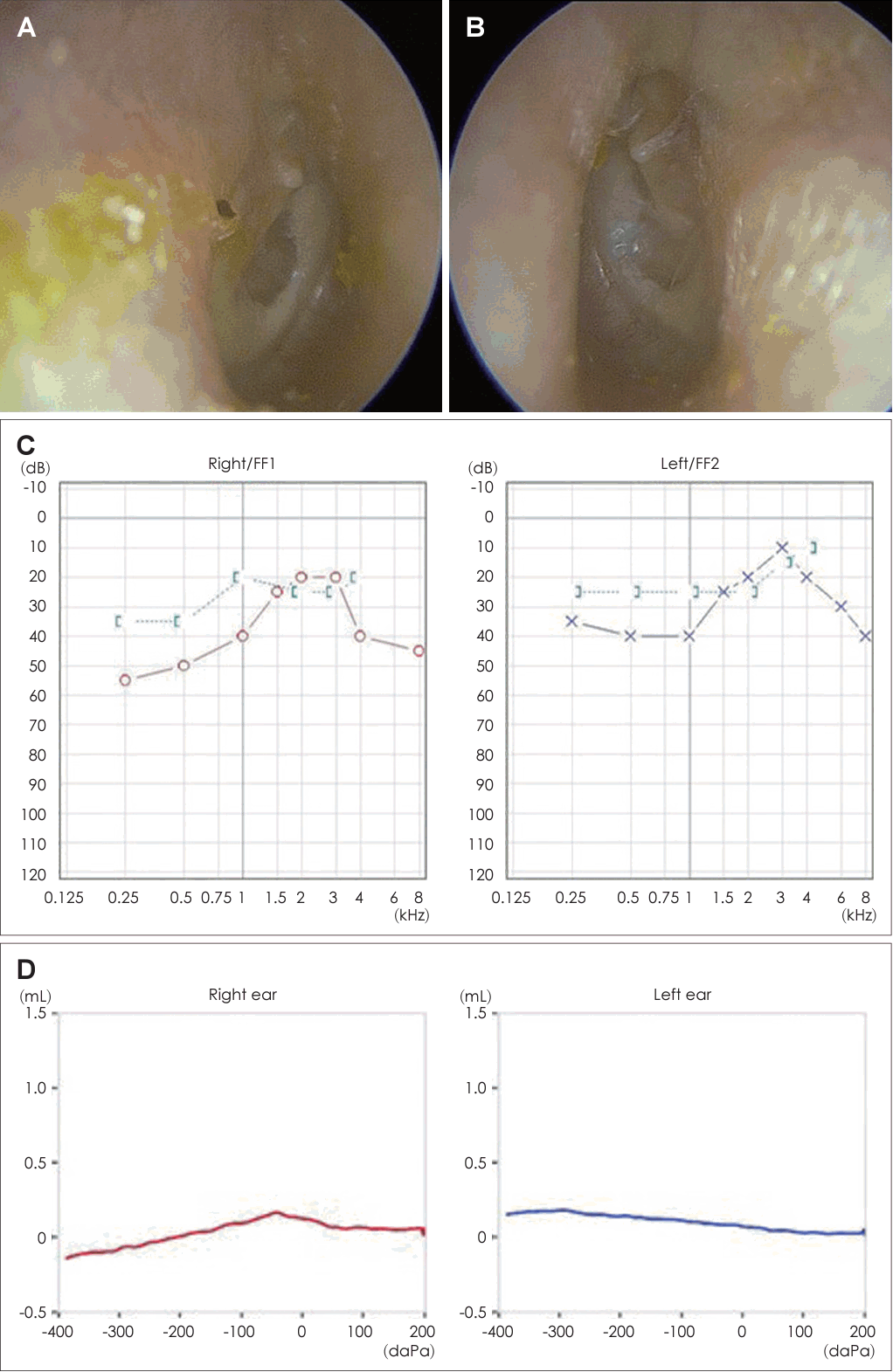
Left middle ear contains partial effusion (A: right, B: left). Pure tone audiogram shows worsened hearing loss with increasing airbone gaps in both ears (C). Tympanogram (D) shows type As in right side (red) and C in left side (blue).
고 찰
OSCS는 X-연관 우성 유전질환으로, 남성 환자의 경우 태아기나 신생아기 사망률이 높아 주로 여성 환자들에게 나타나는 경화성 골이형성증으로 우연히 발견되는 경우가 많다[5]. 사지관상골의 골간단에 세로 줄무늬(longitudinal striation) 뿐만 아니라 두개골의 경화가 중요한 특징 중 하나로서, 이로 인해 안면의 변형이 일어나기도 한다[1,2,6,7]. 이러한 뼈의 변화는 초음파나 단순 방사선 촬영을 통해 태아 또는 유아 시기에 진단할 수 있다[1,8,9]. 또한, 다양한 종류의 선천성 심장병이 동반될 수 있으며, 특히 심실중격결손 및 심방중격결손이 자주 보고된다[8]. 단순 방사선 검사상 사지관상골의 골간단에 국한된 세로줄의 골경화선 및 장골능에서의 부챗살 또는 선상음영의 골경화선이 있다. OSCS 환자 중 다수에서 이경화증이 보고된 바가 있는데 이낭에 골생성은 증가하나 골 재형성이 이루어지지 않은 형태를 띠는 경우가 많다[8]. Jenkins 등[5]은 WTX (Wilms tumor on the X chromosome; FAM123B or AMER1)는 WNT/beta-catenin의 신호 전달을 억제하는 유전자이며, 이것의 돌연변이는 WNT 신호 전달의 증가를 통해 OSCS을 유발한다고 제안한 바가 있으며 Wilms tumor와도 관련이 깊은 것으로 알려져 있어 종양의 가능성에 대해 주의 깊은 관찰이 필요하다[9].
기존에 OSCS로 인한 안면 마비 환자에 대한 국내 보고는 거의 찾을 수 없었다. 환자는 출생시부터 점차적으로 OSCS의 전형적인 증상을 보여왔으나 성인이 될 때까지 유전질환의 가능성에 대해 진단을 받지 못했다. 위와 같은 증상이 중복될 경우 유전성 골격질환의 가능성에 대해 다학제적 접근을 통해 빠른 진단으로 필요한 치료와 상담이 적절한 시기에 진행되도록 만전을 기해야 할 것으로 사료되어 본 증례를 보고하는 바이다.
Acknowledgements
None
Notes
Author Contribution
Conceptualization: Kyung Wook Heo, Tae Ui Hong. Formal analysis: Kyung Wook Heo, Bo Lyun Lee. Investigation: Tae Ui Hong. Methodology: Woo Jin Kim. Project administration: Kyung Wook Heo, Tae Ui Hong, Woo Jin Kim. Resources: Bo Lyung Lee. Supervision: Kyung Wook Heo. Writing—original draft: Tae Ui Hong. Writing—review & editing: Kyung Wook Heo.