 |
 |
AbstractBackground and ObjectivesCochlear implant (CI) changes the way that sound inputs are processed in the brain, possibly causing brain reorganization. Given that the pattern and degree of reorganization are known to be related to speech perception skill, information regarding hemispheric asymmetry can be used to predict behavioral performances in CI users. The current study investigated the hemispheric asymmetry of N1 dipole cortical activity in response to the temporally varied speech sounds and its relationship to speech perception abilities in adult CI users.
Subjects and MethodThe cortical activity was recorded from 64 scalp electrodes in 10 CI users and 11 normal-hearing controls. Speech stimuli were synthesized consonant-vowels, the /ba/-/pa/ continuum that ranged from 0 to 50 ms with a 6-step voice onset time (VOT). N1 dipole amplitudes, latencies, and locations were analyzed as a function of VOT and the direction of implantation. Also investigated was the relationship between N1 dipole lateralization and speech perception.
ResultsFor the N1 dipole location, significant location differences between CI and normal hearing groups were seen at 40 ms VOT in the anterior-posterior direction. For hemispheric asymmetry, the N1 dipole activity in good CI performers was higher in the auditory cortex contralateral to the stimulated ear, while poor CI performers showed greater ipsilateral activity. In addition, a lateralization index at 20 ms VOT showed significant correlation with the /ba/-/pa/ consonant perception scores in noise.
ņä£ ļĪĀņØĖĻ│ĄņÖĆņÜ░(cochlear implant)ļŖö Ļ│Āņŗ¼ļÅä Ļ░ÉĻ░üņŗĀĻ▓Įņä▒ ļé£ņ▓Łņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņ▓ŁĻ░ü(hearing sensation)ņØä ļÉśņé┤ļ”┤ ņłś ņ׳ļŖö ņ£ĀņØ╝ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ Ēśäņ×¼Ļ╣īņ¦Ć ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ļ¦ÄņØĆ ņ▓ŁĻ░üņןņĢĀņØĖļōżņŚÉĻ▓ī ņĀüņÜ®ļÉśņ¢┤ ņÖöļŗż. ņØĖĻ│ĄņÖĆņÜ░ņØś ņé¼ņÜ®ņØĆ ļŗ©ņł£Ē׳ ļ¦Éņ┤łņĀüņØĖ ņ▓ŁĻ░ÉĻ░üņØä ļÉśņé┤ļ”┤ ļ┐Éļ¦ī ņĢäļŗłļØ╝, ņāłļĪ£ņÜ┤ ņ▓ŁĻ░ü ņŗĀĒśĖņØś ņ£Āņ×ģņØä ĒåĄĒĢ£ ļīĆļćīĒö╝ņ¦ł Ļ░Ćņåīņä▒(cortical plasticity)ņØä ņ£ĀļÅäĒĢśņŚ¼ ļīĆļćīĒö╝ņ¦ł ņ×¼ņĪ░ņ¦üĒÖöļź╝ ņ£Āļ░£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[1]. ĒŖ╣Ē׳, ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ£╝ļĪ£ ņ£Āļ░£ļÉ£ ļīĆļćīĒö╝ņ¦ł ņ×¼ņĪ░ņ¦üĒÖöņŚÉ ņØśĒĢ┤ ļćī ĒÖ£ļÅÖņä▒ņØ┤ ņÖ╝ņ¬Į Ēś╣ņØĆ ņśżļźĖņ¬Įņ£╝ļĪ£ ņ╣śņÜ░ņ╣śļŖö ĒśäņāüņØä ņØśļ»ĖĒĢśļŖö ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣Ł(hemispheric asymmetry) ļśÉĒĢ£ ļ░öļĆÉļŗżļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ļ░£Ēæ£ļÉ£ļ░ö ņ׳ļŗż[2]. ņĀĢņāü ņ▓ŁļĀźņØĖņØś Ļ▓ĮņÜ░ ņåīļ”¼ ņ×ÉĻĘ╣ņØä ĒĢ£ņ¬Į ĻĘĆņŚÉ ņĀ£ņŗ£ĒĢśņśĆņØä Ļ▓ĮņÜ░ ņ×ÉĻĘ╣ņØīņØä ņĀ£ņŗ£ĒĢ£ ļ░®Ē¢źĻ│╝ ļÅÖņØ╝ĒĢ£ ļ░śĻĄ¼, ņ”ē ļÅÖņĖĪ(ipsilateral) ļ│┤ļŗż ļīĆņĖĪ(contralateral) ļ░śĻĄ¼ņØś ņ▓ŁĻ░ü Ēö╝ņ¦łņŚÉņä£ ļŹö Ēü░ ļ░śņØæņä▒ņØä ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ ņÖöļŗż[3]. ļ░śļ®┤ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļŖö ņØĖĻ│ĄņÖĆņÜ░ ņ░®ņÜ® ļ░®Ē¢ź, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ ņŗ£ĻĖ░, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ ņł£ņä£, ĻĘĖļ”¼Ļ│Ā ņ▓ŁĻ░ü ņåÉņŗżņØś ĻĖ░Ļ░äĻ│╝ Ļ░ÖņØĆ ņÜöņØĖņŚÉ ļö░ļØ╝ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØś Ēī©Ēä┤ņØ┤ ļŗ¼ļØ╝ņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[4].
ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļīĆļćīĒö╝ņ¦ł ņ×¼ņĪ░ņ¦üĒÖöļź╝ ņé┤ĒÄ┤ļ│Ė ņäĀĒ¢ēņŚ░ĻĄ¼ļōżņŚÉ ņØśĒĢśļ®┤ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ ņŗ£ĻĖ░ņÖĆ ņ¢æņĖĪ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ® ņŚ¼ļČĆĻ░Ć ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØś ļ│ĆĒÖöņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[4]. ņØ┤ļ¤¼ĒĢ£ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØś ļ│ĆĒÖöļŖö ĒŖ╣Ē׳ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņØ┤ņŗØĒĢ£ ņĢäļÅÖ Ēś╣ņØĆ ņ▓ŁņåīļģäņŚÉĻ▓ī ļæÉļō£ļ¤¼ņ¦ĆĻ▓ī ļéśĒāĆļé¼ļŗż. P1 ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļīĆļćīĒö╝ņ¦ł ņ×¼ņĪ░ņ¦üĒÖöļź╝ ņĖĪņĀĢĒĢ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, ĒĢ£ņ¬Į ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņØ┤ņŗØĒĢ£ Ēøä ļŗ©ĻĖ░Ļ░ä ļé┤ņŚÉ ļŗżļźĖ ņ¬ĮņŚÉļÅä ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņØ┤ņŗØĒĢśĻ▒░ļéś, ņ¢æņĖĪ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ļÅÖņŗ£ņŚÉ ņØ┤ņŗØĒĢ£ ņĢäļÅÖļōżņØĆ ņĀĢņāüņĀüņØĖ ņłśņżĆņØś ļīĆņĖĪ ĒÖ£ļÅÖņä▒ņØä ļ│┤ņØĖ ļ░śļ®┤, ņśżļ×£ ĻĖ░Ļ░ä ļÅÖņĢł ĒÄĖņĖĪ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ņĢäļÅÖņŚÉņä£ļŖö ļīĆņĖĪ ļīĆļćīĒö╝ņ¦ł ĒÖ£ļÅÖņä▒ņØ┤ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ļåÆĻ▓ī ļéśĒāĆļé¼Ļ│Ā, ņØ┤ļ¤¼ĒĢ£ Ēī©Ēä┤ņØ┤ Ļ░ĢĒĢśĻ▓ī ļéśĒāĆļéĀņłśļĪØ ļ¦Éņ¦ĆĻ░üļĀź ņĀÉņłśļŖö ļé«Ļ▓ī ļéśĒāĆļé¼ļŗż[4]. ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņśżļ×£ ĻĖ░Ļ░ä ĒÄĖņĖĪ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ņ▓ŁņåīļģäņŚÉĻ▓ī ļŗżļźĖ ĒĢ£ņ¬Į ĻĘĆņŚÉļÅä ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņØ┤ņŗØĒĢ£ Ēøä ļīĆļćī ĒÖ£ļÅÖņä▒ņØä ņĖĪņĀĢĒĢśņśĆļŗż. ņŚ░ĻĄ¼ Ļ▓░Ļ│╝, ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ┤ņÖöļŹś ĻĘĆņŚÉ ņ▓ŁĻ░üņĀü ņ×ÉĻĘ╣ņØä ņĀ£ņŗ£ĒĢśņśĆņØä ļĢī ņĀĢņāüņØĖņŚÉ ļ╣äĒĢ┤ Ēø©ņö¼ Ēü░ ļīĆņĖĪ ĒÖ£ļÅÖņä▒ņØ┤ ļéśĒāĆļé¼ņ£╝ļéś, ņāłļĪ£ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņØ┤ņŗØĒĢ£ ĻĘĆņŚÉ ņ▓ŁĻ░ü ņ×ÉĻĘ╣ņØä ņĀ£ņŗ£ĒĢśņśĆņØä ļĢīņŚÉļŖö ļīĆļćīĒö╝ņ¦ł ĒÖ£ļÅÖņä▒ņØ┤ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ Ēü¼Ļ│Ā ļćī ņĀäņ▓┤ņŚÉ ĒŹ╝ņ¦ä ņ¢æņāüņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ļśÉĒĢ£ ņØ┤ļ¤¼ĒĢ£ ļćī ĒÖ£ļÅÖņä▒ņØĆ ļŗ©ņ¢┤ ņ¦ĆĻ░üļĀźĻ│╝ ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļéśĒāĆļé┤ņŚłļŗż[5]. ļö░ļØ╝ņä£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļ░śĻĄ¼ņä▒ ļ╣äļīĆņ╣Ł Ēī©Ēä┤ņØś ļ│ĆĒÖöļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ£ ļīĆļćīĒö╝ņ¦łņØś ņ×¼ņĪ░ņ¦üĒÖöļź╝ ļ░śņśüĒĢ£ļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŗż.
ĻĖ░ļŖźņĀü ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü(functional magnetic resonance image)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņØ┤ņŗØĒĢ£ ņä▒ņØĖņØś ļīĆļćīĒö╝ņ¦ł ņ×¼ņĪ░ņ¦üĒÖöļź╝ Ļ┤Ćņ░░ĒĢ£ ņäĀĒ¢ēņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, ļ¦Éņåīļ”¼ ņØĖņ¦ĆņÖĆ ņŚ░Ļ┤ĆļÉ£ ņØīņÜ┤ ņČĢņĢĮ(phonological process)ņØä ņ▓śļ”¼ĒĢĀ ļĢī ņāüĒøäņןĻ│©ĻĘ╣ņĖĪļæÉ ņØ┤ļ×æ(posterior superior temporal gyrus)Ļ│╝ ņŚ░ņāüĒÜī(supramarginal gyrus)ļź╝ ĒżĒĢ©ĒĢ£ ņśżļźĖņ¬Į ņĖĪļæÉņŚĮ ļČĆņ£äĻ░Ć ņÖ╝ņ¬Į ļ░śĻĄ¼ņØś ņĖĪļæÉņŚĮņŚÉ ļ╣äĒĢ┤ ļŹöņÜ▒ ĒÖ£ņä▒ĒÖöļÉ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[6]. 18F-fluorodeoxyglucose positron emission tomography(18FFDG PET)ņØä ņØ┤ņÜ®ĒĢ£ ļīĆļćī ņŚ░Ļ▓░ņä▒ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņØ╝ņ░© ņ▓ŁĻ░ü Ēö╝ņ¦ł(primary auditory cortex)ņØś ļīĆņé¼ņ£©ņØ┤ ņØĖĻ│ĄņÖĆņÜ░ ņ░®ņÜ® ĻĘĆņØś ļÅÖņĖĪ ļ░śĻĄ¼ņŚÉņä£ ĻĖ░ļŖźņĀü ņŚ░Ļ▓░ņä▒ņØ┤ ļŹö ļåÆĻ▓ī ļéśĒāĆļé¼ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ļ░śĻĄ¼ņä▒ ļ╣äļīĆņ╣Ł ĒśäņāüņØĆ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ņä▒ņØĖņŚÉ ļ╣äĒĢ┤ ņĢäļÅÖņŚÉņä£ ļŹö ļæÉļō£ļ¤¼ņ¦ĆĻ▓ī Ļ┤Ćņ░░ļÉśņŚłļŗż[7]. ĒĢśņ¦Ćļ¦ī ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ņä▒ņØĖņØä ļīĆņāüņ£╝ļĪ£ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØä Ļ┤Ćņ░░ĒĢ£ ņäĀĒ¢ēņŚ░ĻĄ¼ļōżņØĆ ļ╣äļīĆņ╣Ł Ēī©Ēä┤ņŚÉ ļīĆĒĢ┤ ņāüņØ┤ĒĢ£ Ļ▓░Ļ│╝ļōżņØä ļ│┤Ļ│ĀĒĢśņśĆļŖöļŹ░, ĻĘĖ ņøÉņØĖ ņżæ ĒĢśļéśļŖö ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ tone burst Ēś╣ņØĆ Ēü┤ļ”ŁņØī Ļ░ÖņØĆ ļŗ©ņł£ņØīņØä ņé¼ņÜ®ĒĢśņŚ¼ ļīĆļćī ĒÖ£ļÅÖņä▒ņØä ņĖĪņĀĢĒĢśņśĆĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ļ│┤ņØĖļŗż. ņŗżņĀ£ļĪ£ Ēü┤ļ”Ł Ļ░ÖņØĆ, ņ×ÉņŚ░ņØīĻ│╝ļŖö ļÅÖļ¢©ņ¢┤ņ¦ä ņåīļ”¼ļōżņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļīĆļćīĒö╝ņ¦ł ĒÖ£ļÅÖņØä ņĖĪņĀĢĒĢśļŖö Ļ▓ĮņÜ░ Ļ▓░Ļ│╝ņØś ņØ╝Ļ┤Ćņä▒ņØ┤ ļ¢©ņ¢┤ņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[6]. ļö░ļØ╝ņä£ ņŗżņĀ£ ļ¦Éņåīļ”¼ņÖĆ ņ£Āņé¼ĒĢ£ ņ×ÉņŚ░ņŖżļ¤¼ņÜ┤ ņåīļ”¼ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ļīĆļćīĒö╝ņ¦łņØś ņ×¼ņĪ░ņ¦üĒÖöņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļŹöņÜ▒ ĒĢäņÜöĒĢ£ ņŗżņĀĢņØ┤ļŗż. ņØ╝ļČĆ ņŚ░ĻĄ¼ļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×É ņé¼ņØ┤ņŚÉ ļ│┤ņØ┤ļŖö ļ¦Éņ¦ĆĻ░ü ļŖźļĀźņØś ņ░©ņØ┤Ļ░Ć ĻĘĖļōżņØś ņŗĀĻ▓Į Ļ░Ćņåīņä▒ ņåŹļÅäņÖĆ ņĀĢļÅä ņ░©ņØ┤ņŚÉ ĻĖ░ņØĖĒĢ£ļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆļŗż[8]. ņśłļź╝ ļōżņ¢┤, ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņŚÉĻ▓ī ņŗ£Ļ░ü ņ×ÉĻĘ╣ņØä ņĀ£ņŗ£ĒĢśņśĆņØä ļĢī ņ▓ŁĻ░ü ņżæņČöĻ░Ć ņŗ£Ļ░ü ņ×ÉĻĘ╣ņØä ņ▓śļ”¼ĒĢśļŖö ļŹ░ Ļ┤ĆņŚ¼ĒĢśļŖö ĻĄÉņ░© Ļ░ÉĻ░ü ņ×¼ņĪ░ņ¦üĒÖö(cross-modal reorganization)Ļ░Ć ņØ╝ņ¢┤ļéśļŖö ĒśäņāüņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņ×¼ņĪ░ņ¦üĒÖöņØś ņĀĢļÅäļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļ¦Éņ¦ĆĻ░üļĀźĻ│╝ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[9,10]. ļö░ļØ╝ņä£ ņ▓ŁĻ░ü ņåÉņŗżĻ│╝ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņŚÉ ļö░ļźĖ ļīĆļćī ņ×¼ņĪ░ņ¦üĒÖöņØś ļ│ĆĒÖöļź╝ ņĖĪņĀĢĒĢśĻ│Ā, Ļ░ØĻ┤ĆņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢ£ ļīĆļćī ĒÖ£ļÅÖņä▒Ļ│╝ ņŻ╝Ļ┤ĆņĀüņØĖ Ē¢ēļÅÖņĀü ņłśĒ¢ēļĀźĻ│╝ņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ░ØĒ׳ļŖö Ļ▓āņØĆ Ļ│╝ĒĢÖņĀü, ĻĘĖļ”¼Ļ│Ā ņ×äņāüņĀüņ£╝ļĪ£ ņżæņÜöĒĢśļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļćīņĀäļÅä(electroencephalography) ĻĖ░ņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ N1 ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉņØä ņĖĪņĀĢĒĢśņŚ¼ ņŗ£Ļ░äņĀü ļ│ĆĒÖöļź╝ ĒżĒĢ©ĒĢ£ ļ¦Éņåīļ”¼ņŚÉ ļö░ļźĖ ļīĆļćī ĒÖ£ļÅÖņä▒ņØś ļ│ĆĒÖöņÖĆ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż. N1ņØä ņäĀĒāØĒĢ£ ņØ┤ņ£ĀļŖö ņ▓ŁĻ░ü ņé¼Ļ▒┤ Ļ┤ĆļĀ© ņĀäņ£ä(auditory event-related potential, AEP)ļź╝ ĻĄ¼ņä▒ĒĢśļŖö ņŚ¼ļ¤¼ ĒĢśņ£ä ņä▒ļČä ņżæ N1ņØ┤ ņ▓ŁĻ░ü Ļ┤ĆļĀ© ņĀĢļ│┤ņŚÉ Ļ░Ćņן ļ»╝Ļ░ÉĒĢśĻ▓ī ļ░śņØæĒĢśļŖö ņä▒ļČäņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[11,12]. ļśÉĒĢ£, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 6Ļ░Ćņ¦Ć ļŗ©Ļ│äņØś ņØīņä▒Ļ░£ņŗ£ņŗ£Ļ░ä(voice onset time, VOT)ņØ┤ ĒżĒĢ©ļÉ£ ļ¦Éņåīļ”¼ļź╝ ņåīļ”¼ ņ×ÉĻĘ╣ņ£╝ļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż. ņĀĢņāü ņ▓ŁļĀźņØĖņØä ļīĆņāüņ£╝ļĪ£ VOTņØś ĻĖĖņØ┤ ļ│ĆĒÖöņŚÉ ļö░ļźĖ N1ņØś ļ│ĆĒÖöļź╝ Ļ┤Ćņ░░ĒĢśņśĆņØä ļĢī, VOTĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ N1ņØś ņ¦äĒÅŁņØ┤ ņ×æņĢäņĪīņ£╝ļ®░[13], ĻĖ┤ VOTļź╝ Ļ░Ćņ¦ä ņ▓ŁĻ░ü ņ×ÉĻĘ╣ņØä ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ļæÉ Ļ░£ņØś N1 ņĀĢņĀÉ(double peak)ņØ┤ ļéśĒāĆļé¼ļŗż[14]. ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś N1Ļ│╝ ļ¦Éņ¦ĆĻ░üļĀźņØä ņĪ░ņé¼ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö VOTņØś ĻĖĖņØ┤ņŚÉ ļö░ļźĖ N1ņØś ļ│ĆĒÖöņÖĆ ļ¦Éņ¦ĆĻ░ü ļŖźļĀź Ļ░äņØś ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ĒÖĢņØĖĒĢśņśĆļŗż[15]. ļśÉĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ VOTņŚÉ ļö░ļźĖ ļ▓öņŻ╝ ņ¦ĆĻ░üĻ│╝ N1ņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĢīņĢäļ│Ė ņĄ£ĻĘ╝ ņäĀĒ¢ēņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ¦Éņ¦ĆĻ░üļĀźņØ┤ ļé«ņØäņłśļĪØ ļ▓öņŻ╝ ņ¦ĆĻ░ü(categorical perception)ņØ┤ ļéśĒāĆļéśļŖö VOTĻ░Ć ļŖ”ņ¢┤ņ¦Ćļ®░, ņØ┤ļŖö N1 ņ¦äĒÅŁĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżĻ│Ā ļ░ØĒ×īļ░ö ņ׳ļŗż[16].
ļö░ļØ╝ņä£, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö VOT ļ│ĆĒÖöņŚÉ ļö░ļźĖ N1 ņīŹĻĘ╣ņ×É ņ¦äĒÅŁ ļ░Å ņ×Āņ×¼ĻĖ░ņØś ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤Ļ│Ā, ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØä ņłśņ╣śņĀüņ£╝ļĪ£ ļéśĒāĆļé╝ ņłś ņ׳ļŖö N1 ņīŹĻĘ╣ņ×ÉņØś ĒÄĖņ×¼ĒÖö ņ¦Ćņłś(lateralization index)ļź╝ Ļ│äņé░ĒĢśņŚ¼ ļīĆļćī ĒÄĖņĖĪĒÖöļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ĒŖ╣Ē׳, ļ▓öņŻ╝ ņ¦ĆĻ░üĻ│╝ N1 ņ¦äĒÅŁņØś ļ│ĆĒÖöļź╝ ņĖĪņĀĢĒĢ£ ņäĀĒ¢ēņŚ░ĻĄ¼ņŚÉņä£ /ļ░ö/ņÖĆ /Ēīī/ļź╝ ĻĄ¼ļČäĒĢśļŖö ļ▓öņŻ╝ ņ¦ĆĻ░üņØś Ļ▓ĮĻ│äĻ░Ć ņĢĮ 20 ms VOTņŚÉņä£ ļéśĒāĆļé£ļŗżĻ│Ā ļ░ØĒ×īļ░ö ņ׳ņ£╝ļ»ĆļĪ£[16], ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 20 msņØś ĒÄĖņ×¼ĒÖö ņ¦Ćņłśļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļōżņØś ļ¦Éņ¦ĆĻ░üļĀźĻ│╝ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż.
ļīĆņāü ļ░Å ļ░®ļ▓ĢņŚ░ĻĄ¼ ļīĆņāüļ│Ė ņŚ░ĻĄ¼ļź╝ ņ£äĒĢ┤ ņśüņ¢┤ļź╝ ļ¬©ĻĄŁņ¢┤ļĪ£ ĒĢśļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×É 10ļ¬ģ(ļé© 4ļ¬ģ, ņŚ░ļĀ╣ ļ▓öņ£ä: 32~74ņäĖ, ĒÅēĻĘĀ: 49.6ņäĖ)Ļ│╝ ņĀĢņāü ņ▓ŁļĀźņØä Ļ░Ćņ¦ä ņä▒ņØĖ 11ļ¬ģ(ļé© 4ļ¬ģ, ņŚ░ļĀ╣ ļ▓öņ£ä: 20~42ņäĖ, ĒÅēĻĘĀ: 31ņäĖ)ņØ┤ ņ░ĖņŚ¼ĒĢśņśĆņ£╝ļ®░, ļ¬©ļōĀ Ēö╝ĒŚśņ×ÉļŖö ņśżļźĖņåÉņ×ĪņØ┤ņśĆļŗż. ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļōżņØĆ ņŗĀņŗ£ļé┤Ēŗ░ ņĢäļÅÖ ļ│æņøÉņØś ņ×äņāüņŗ£ĒŚśņ£żļ”¼ņ£äņøÉĒÜī ĒöäļĪ£ĒåĀņĮ£(IRB No. 2013-0105)ņŚÉ ļö░ļØ╝ ļ¬©ņ¦æļÉśņŚłņ£╝ļ®░, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ Ēøä 1ļģä ņØ┤ ņ¦Ćļé¼ņ£╝ļ®░, ĒĢśļŻ©ņŚÉ ņĀüņ¢┤ļÅä 8ņŗ£Ļ░ä ņØĖĻ│ĄņÖĆņÜ░ļź╝ ĻŠĖņżĆĒ׳ ņ░®ņÜ®ĒĢśņśĆļŗżĻ│Ā ļ│┤Ļ│ĀĒĢ£ ņä▒ņØĖņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. 10ļ¬ģņØś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×É ņżæ 2ļ¬ģņØś ļé£ņ▓Ł ļ░£ņāØņŗ£ĻĖ░ļŖö ņ¢Ėņ¢┤ ņŖĄļōØ ņØ┤ņĀä, 8ļ¬ģņØĆ ņ¢Ėņ¢┤ ņŖĄļōØ ņØ┤ĒøäņØĖ ņä▒ņØĖņ£╝ļĪ£, ņłśņłĀ ņĀä ņ▓ŁļĀźņØĆ ļīĆņāüņ×É ļ¬©ļæÉ Ļ│ĀļÅä ņØ┤ņāüņØ┤ņŚłļŗż. ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ Ēö╝ĒŚśņ×É ļ¬©ļæÉ ņ¢æņ¬Į ĻĘĆņØś ļ¦Éņ¦ĆĻ░üļĀźņØä ņŗżņŗ£ĒĢśņŚ¼ ņłśĒ¢ēļĀźņØ┤ ļŹö ņóŗņØĆ ĒĢ£ņ¬Į ĻĘĆņŚÉļ¦ī ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ņāüĒā£ļĪ£ ļ│Ė ņŗżĒŚśņŚÉ ņ░ĖĻ░ĆĒĢśņśĆļŗż. ņØĖĻ│ĄņÖĆņÜ░ ļīĆņāüņ×ÉņØś ņŚ░ļĀ╣, ņä▒ļ│ä, ņØĖĻ│ĄņÖĆņÜ░ ņ░®ņÜ® ĻĘĆ, ņ░®ņÜ® ĻĖ░Ļ░ä, ņØĖĻ│ĄņÖĆņÜ░ ņäĖļČĆņĀĢļ│┤ļŖö Table 1ņŚÉ, ĻĘĖļ”¼Ļ│Ā ļ¦Éņ¦ĆĻ░üļĀź Ļ▓Ćņé¼ Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ļŖö Table 2ņŚÉ ņĀ£ņŗ£ĒĢśņśĆļŗż. ļśÉĒĢ£, ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØĆ ļ¬©ņØīĻ│╝ ņ×ÉņØī ņØĖņ¦Ć Ļ▓Ćņé¼(Vowel and Consonant Recognition Test)ņÖĆ ņåīņØī ĒĢś ļ¦Éņ¦ĆĻ░ü(Speech Perception In Noise, SPIN) Ļ▓Ćņé¼ļź╝ ņłśĒ¢ēĒĢśņŚ¼ ņÜ░ņłś(good)ĻĄ░Ļ│╝ ņĀĆņĪ░(poor)ĻĄ░ņØś ļæÉ ĻĘĖļŻ╣ņ£╝ļĪ£ ĻĄ¼ļ│äĒĢśņśĆļŗż. SPIN Ļ▓Ćņé¼ļŖö http://www.tigerspeech.comņŚÉ ļ¼┤ļŻī ļ░░ĒżļÉ£ Ļ▓Ćņé¼ ļÅäĻĄ¼ļź╝ ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░, ņ┤Ø 50Ļ░£ņØś ļ¼ĖĒĢŁņØä ļōŻĻ│Ā ļö░ļØ╝ ļ¦ÉĒĢśļŖö Ļ▓Ćņé¼ļĪ£ņä£, ļŗ©ņ¢┤ņÖĆ ļ¼Ėņן ņłśņżĆņØś ņ¦ĆĻ░üļĀźņØä ņĖĪņĀĢĒĢĀ ņłś ņ׳ļŗż. ņ×ÉņØī Ļ▓Ćņé¼ļŖö ņ┤Ø 16Ļ░£ņØś ŌĆ£a/C/aŌĆØ ĻĄ¼ņĪ░ļĪ£ ņ┤Ø 400ĒÜī ņĀ£ņŗ£ļÉśņŚłņ£╝ļ®░, ļ¬©ņØīņØĆ ŌĆ£h/V/dŌĆØņØś ĻĄ¼ņĪ░ļĪ£ 10Ļ░£ņØś ļŗ©ļ¬©ņØī ļ░Å 2Ļ░£ņØś ņØ┤ņżæ ļ¬©ņØī ļ╣äņ£©ļĪ£ ņ┤Ø 300Ļ░£ņØś ļ¬©ņØīņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. ņ┤Ø 10ļ¬ģņØś ņØĖĻ│ĄņÖĆņÜ░ Ēö╝ĒŚśņ×É ņżæ 40ņĀÉ ņØ┤ĒĢśņØś ņ┤ØņĀÉ(composite score)ņØä ļ│┤ņØĖ 4ļ¬ģņØś ņé¼ņÜ®ņ×ÉļōżņØĆ ņĀĆņĪ░ ņé¼ņÜ®ņ×ÉĻĄ░ņ£╝ļĪ£, 50ņĀÉ ņØ┤ņāüņØś ņ┤ØņĀÉņØä Ļ░Ćņ¦ä 6ļ¬ģņØś ņé¼ņÜ®ņ×ÉļōżņØĆ ņÜ░ņłś ņé¼ņÜ®ņ×ÉĻĄ░ņ£╝ļĪ£ ļČäļźśļÉśņŚłļŗż.
Ļ▒┤ņ▓ŁņØĖ 11ļ¬ģņØĆ ļ¬©ļæÉ ņ¢æņØ┤ ņł£ņØīņ▓ŁļĀźĻ▓Ćņé¼ Ļ▓░Ļ│╝ 250 HzļČĆĒä░ 8000 HzĻ╣īņ¦Ć ņśźĒāĆļĖī ļŗ©ņ£ä ņŻ╝ĒīīņłśņŚÉņä£ 15 dB HL ņØ┤ĒĢśņØś ņĀĢņāü ņ▓ŁļĀźņØä ļ│┤ņśĆļŗż. ļ¬©ļōĀ ņ░ĖņŚ¼ņ×ÉļŖö ļÅÖņØśņä£ ņä£ļ¬ģ Ēøä ņŗżĒŚśņŚÉ ņ░ĖņŚ¼ĒĢśņśĆļŗż.
ņ×ÉĻĘ╣ņØīņ×ÉĻĘ╣ņØīņØĆ ĒĢśņŖżĒé©ņŖż ņŚ░ĻĄ¼ņåī(Haskins laboratories)Ļ░Ć Ļ░£ļ░£ĒĢ£ Abramson/Lisker VOT ņ×ÉĻĘ╣ņØīņŚÉņä£ ņłśņĀĢļÉ£ 6ļŗ©Ļ│äņØś /ļ░ö/ - /Ēīī/ VOT ņŚ░Ļ▓░ņ▓┤ļĪ£, ņØ┤ 6Ļ░£ņØś ņØīņĀłņØĆ Ļ░üĻ░ü 0 msņŚÉņä£ļČĆĒä░ 50 msĻ╣īņ¦Ć 10 msņØś Ļ░äĻ▓®ņ£╝ļĪ£ ļäōņ¢┤ņ¦ĆļŖö 6Ļ░£ņØś VOTļź╝ ĒżĒĢ©ĒĢ£ļŗż(http://www.haskins.yale.edu/featured/demo-lisk-abram/index.html). Fig. 1ņØĆ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ļÉ£ 0 ms VOTņØś ĒīīĒśĢĻ│╝ ņ×ÉĻĘ╣ņØīņŚÉ ļö░ļźĖ ņØĖĻ│ĄņÖĆņÜ░ ņ×ĪņØī(artifact)Ļ│╝ ĒåĀĒżĻĘĖļלĒö╝(topography)ļź╝ ļ│┤ņŚ¼ņżĆļŗż. ļ¬©ļōĀ ņ×ÉĻĘ╣ņØīņØĆ VOT ĻĄ¼Ļ░äņØä ĒżĒĢ©ĒĢśĻ│Ā, ņ×ģņłĀņŚÉ ņØśĒĢ£ ĒīīņŚ┤ ĻĄ¼Ļ░äņØä ņ¦Ćļéś ļ¬©ņØī /ŃģÅ/ļĪ£ ļüØļéśļŖö ĒśĢņŗØņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņŚłņ£╝ļ®░, ņ×ÉĻĘ╣ņØīņØś ņ┤Ø ņ¦ĆņåŹņŗ£Ļ░äņØĆ 180 m sņ£╝ļĪ£ ļ¬©ļæÉ ļÅÖņØ╝ĒĢśĻ▓ī ņ£Āņ¦ĆĒĢśņśĆļŗż. ņ×ÉĻĘ╣ņØīņØĆ ņ¦üņĀæ ņĀ£ņ×æĒĢ£ Matlab(MathWorks, Natick, MA, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Tucker-Davis Technologies(TDT, Alachua, FL, USA) ņé¼ņØś RZ5ļź╝ ĒåĄĒĢ┤ ĒśĖĒÖś Ļ░ĆļŖźĒĢ£ ļööņ¦ĆĒäĖ ņé¼ņÜ┤ļō£ ĒīīņØ╝ļĪ£ ļ│ĆĒÖśĒĢśņŚ¼ ņĀäļŗ¼ļÉśņŚłĻ│Ā, ļÅÖņŗ£ņŚÉ TDTļź╝ ĒåĄĒĢ┤ ņŗĀĒśĖĻ░Ć ņĀäļŗ¼ļÉśļŖö ņŗ£Ļ░äņØä ņŗżņŗ£Ļ░äņ£╝ļĪ£ ņ╗┤Ēō©Ēä░ņŚÉ ņĀĆņןĒĢśņśĆļŗż. Bruel and Kj├”r 2260 ņé¼ņÜ┤ļō£ ļĀłļ▓©ļ»ĖĒä░(Bruel and Kj├”r, N├”rum, Denmark)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņåīļ”¼ņØś Ļ░ĢļÅäļź╝ ļ│┤ņĀĢĒĢśņśĆļŗż.
ņŚ░ĻĄ¼ ņĀłņ░©ļćīĒīī ņĖĪņĀĢļćīĒīīļŖö 64ņ▒äļäÉ ļćīĒīīņĖĪņĀĢĻĖ░(actiChamp; Brain Products GmbH, Munich, Germany)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼, ņĀäĻĘ╣ņØ┤ ļČĆņ░®ļÉ£ ņ║ĪņØä ļæÉĒö╝ņŚÉ ņöīņøī ņĖĪņĀĢĒĢśņśĆļŗż. ņĀæņ¦Ć ņĀäĻĘ╣ņØĆ ļ╣äĻĘ╝ņĀÉ(ļ»ĖĻ░ä; nasion)Ļ│╝ Cz ņ£äņ╣śņØś ņżæĻ░ä ņ¦ĆņĀÉņŚÉ ņ£äņ╣śĒĢśļÅäļĪØ ņĪ░ņĀłĒĢśņśĆņ£╝ļ®░ ņ┤Ø 64Ļ░£ ņżæ ĒĢ£ Ļ░£ļŖö ĻĖ░ņżĆ ņĀäĻĘ╣ņ£╝ļĪ£ CzņŚÉ ņ£äņ╣śĒĢśņśĆĻ│Ā, ļéśļ©Ėņ¦Ć 63Ļ░£ņØś ņĀäĻĘ╣ņŚÉņä£ ļćīĒīīļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļō▒Ļ▒░ļ”¼ ļĀłņØ┤ņĢäņøāņØ┤ ņĀüņÜ®ļÉ£ ņĀäĻĘ╣ ņ║ĪņØä ņé¼ņÜ®ĒĢśņśĆļŖöļŹ░, ņØ┤ ņ║ĪņØĆ international 10-20 ņŗ£ņŖżĒģ£ņØä ļö░ļź┤ņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ CzņØś ņ£äņ╣śņŚÉ Ļ░Ćņן Ļ░ĆĻ╣īņÜ┤ 3Ļ░£ņØś ņĀäĻĘ╣ņŚÉņä£ ņ¢╗ņ¢┤ņ¦ä ļćīĒīīņØś Ļ░ÆņØä ĒÅēĻĘĀĒĢśņŚ¼ N1ņØä ņĖĪņĀĢĒĢśņśĆļŗż. ņ×ÉĻĘ╣ņØīņØĆ Ēö╝ĒŚśņ×ÉļĪ£ļČĆĒä░ 1.5 m ņĢ× ņĀĢļ®┤ņŚÉ ņ£äņ╣śĒĢ£ ņŖżĒö╝ņ╗żļź╝ ĒåĄĒĢ┤ ņŠīņĀüĻ░ĢļÅäļĀłļ▓©(most comfortable level, MCL) ņłśņżĆņØś Ēü¼ĻĖ░ļĪ£ ņ░©ĒÅÉ ļ░®ņØīņŗż ņĢłņŚÉņä£ ņĀ£ņŗ£ļÉśņŚłļŗż. ņ×ÉĻĘ╣ņØī ņé¼ņØ┤ ĻĄ¼Ļ░ä(inter-stimulus interval, ISI)ņØĆ 1.5ņ┤łļĪ£ņä£ ņ×ÉĻĘ╣ņØīņØ┤ ļüØļé£ Ēøä 1.5ņ┤łņØś Ē£┤ņ¦Ć ĻĄ¼Ļ░äņØä ņ¦Ćļéś ĻĘĖļŗżņØī ņ×ÉĻĘ╣ņØīņØ┤ ņĀ£ņŗ£ļÉśņŚłļŗż. ļ¬©ļōĀ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļŖö ņÖ╝ņ¬Į Ēś╣ņØĆ ņśżļźĖņ¬Į ĻĘĆ ņżæ ņ▓ŁļĀź ņŚŁņ╣śĻ░Ć ļŹö ļé«ņØĆ ĒĢ£ņ¬Į ĻĘĆņŚÉļ¦ī ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ņāüĒā£ļĪ£ ņ▓ŁĻ░ü ņ£Āļ░£ ņĀäņ£ä ņĖĪņĀĢņØä ņŗżņŗ£ĒĢśņśĆļŗż. ņĀĢņāü ņ▓ŁļĀź ļīĆņĪ░ĻĄ░ņØĆ ņŖżĒö╝ņ╗żļź╝ ĒåĄĒĢ┤ ņ¢æņ¬Į ĻĘĆļĪ£ ņåīļ”¼ļź╝ ņĀäļŗ¼ļ░øņĢśņ£╝ļ®░, 70 dBņØś Ļ░ĢļÅäļĪ£ ņ×ÉĻĘ╣ņØīņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. ņŗżĒŚś ņŗ£ Ēö╝ĒŚśņ×ÉļŖö ņ×ÉņŗĀņØ┤ ņäĀĒāØĒĢ£ ņØīņåīĻ▒░ ļÉ£ ņśüĒÖöļź╝ ņŗ£ņ▓ŁĒĢśņśĆņ£╝ļ®░, ņØ┤ĒĢ┤ļź╝ ņ£äĒĢ┤ ņ×Éļ¦ēņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. ņ¦æņżæņŚÉ ņØśĒĢ£ ĒĢśĒ¢źņŗØ ņ▓śļ”¼(top-down processing)ņØś ņśüĒ¢źņØä ņĄ£ņåīĒÖöĒĢĀ ņłś ņ׳ļÅäļĪØ ņŗżĒŚśņØä ņŗ£ņ×æĒĢśĻĖ░ņŚÉ ņĢ×ņä£ Ēö╝ĒŚśņ×ÉņŚÉĻ▓ī ņśüĒÖöņŚÉ ņĄ£ļīĆĒĢ£ ņ¦æņżæĒĢśĻ│Ā, ņ×ÉĻĘ╣ņØīņØĆ ļ¼┤ņŗ£ĒĢśļÅäļĪØ ņ¦Ćņŗ£ĒĢśņśĆļŗż. Ļ░ü VOT ņ×ÉĻĘ╣ņØī ļŗ╣ 200ĒÜīņö® ņ┤Ø 1200ĒÜī(6 VOTs├Ś200ĒÜī)ņØś ņ×ÉĻĘ╣ņØīņØ┤ ņĀĢņāü ņ▓ŁļĀźĻĄ░ņŚÉĻ▓ī ņĀ£ņŗ£ļÉśņŚłĻ│Ā, ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØś Ļ▓ĮņÜ░ ņØĖĻ│ĄņÖĆņÜ░ņŚÉ ņØśĒĢ£ ņ×ĪņØī(noise)ņØ┤ ļ¦ÄņØ┤ ļ░£ņāØĒĢśļ»ĆļĪ£, ņ×ÉĻĘ╣ņØī ļŗ╣ ņĄ£ņåī 400ĒÜīņö® ņ┤Ø 2400ĒÜī(6 VOTs├Ś400ĒÜī)ņØś ņ×ÉĻĘ╣ņØīņØ┤ 4Ļ░£ņØś ļĖöļĪØņŚÉ Ļ▒Ėņ│É ņĀ£ņŗ£ļÉśņŚłļŗż. ļćīĒīī ņĖĪņĀĢ Ēøä Polhemus Patriot 3D ļööņ¦ĆĒāĆņØ┤ņĀĆ(Polhemus, Colchester, VT, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ļ░ü Ēö╝ĒŚśņ×ÉņØś ņĀĢĒÖĢĒĢ£ ņĀäĻĘ╣ ņ£äņ╣śļź╝ ĻĖ░ļĪØĒĢśņśĆņ£╝ļ®░, ņØ┤ļŖö ņīŹĻĘ╣ņ×É ļČäņäØņŚÉ ņé¼ņÜ®ļÉśņŚłļŗż. ļŹ░ņØ┤Ēä░ ņĀĆņן ņŗ£ Ēæ£ļ│Ėņ£©(sampling rate)ņØĆ 1000 HzņśĆĻ│Ā ļ¬©ļōĀ ļŹ░ņØ┤Ēä░ļŖö ņśżĒöäļØ╝ņØĖ ļČäņäØņØä ņ£äĒĢ┤ ņĀĆņןļÉśņŚłļŗż. ļ¬©ļōĀ ņ×ÉĻĘ╣ņØīņØĆ ņśłņĖĪ ĒÜ©Ļ│╝ļź╝ ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤ ļ¼┤ņ×æņ£ä ņł£ņä£ļĪ£ ņĀ£ņŗ£ļÉśņŚłņ£╝ļ®░, ņ┤Ø ļćīĒīī ņĖĪņĀĢ ņŗ£Ļ░äņØĆ ņĀĢņāü ņ▓ŁļĀźņØĖņØś Ļ▓ĮņÜ░ ĒÅēĻĘĀ 1.5 ņŗ£Ļ░ä, ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļŖö ĒÅēĻĘĀ 2.5 ņŗ£Ļ░äņØ┤ ņåīņÜöļÉśņŚłĻ│Ā, Ļ░ü ņäĖņģś ņé¼ņØ┤ņÖĆ Ēö╝ĒŚśņ×ÉĻ░Ć ņøÉĒĢśļŖö ļĢīņŚÉ Ē£┤ņŗØ ņŗ£Ļ░äņØ┤ ņŻ╝ņ¢┤ņĪīļŗż.
ļćīĒīīņØś ņĀäņ▓śļ”¼ ļ░Å ĻĖ░ļĪØļćīĒīīņØś ņĀäņ▓śļ”¼(preprocessing) ļ░Å ļČäņäØņØĆ B rain V ision Analyzer 2.0(Brain Products GmbH)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņŗżņŗ£ļÉśņŚłļŗż. ņĖĪņĀĢļÉ£ ļćīĒīīļŖö ļ©╝ņĀĆ Ļ│ĀļīĆņŚŁ ĒåĄĻ│╝ ĒĢäĒä░(high-pass filter)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņĀĆņŻ╝ĒīīņŚÉņä£ ļ░£ņāØĒĢśļŖö ņ×ĪņØī ņŗĀĒśĖļź╝ ņĀ£Ļ▒░ĒĢśĻĖ░ ņ£äĒĢ┤ 0.01 Hz ņØ┤ĒĢś ņŻ╝Ēīīņłśļź╝ ņ░©ļŗ©ĒĢśņśĆĻ│Ā, Ēæ£ļ│Ėņ£©ņØä 512 HzļĪ£ ļé«ņČöņŚłļŗż. ļśÉĒĢ£, ĒåĄĻ│╝ ņŻ╝Ēīīņłś ļīĆņŚŁ ĒĢäĒä░ļ¦ü(band-pass filter)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀäņøÉņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö ņ×ĪņØī(60 Hz)ņØä ņ░©ļŗ©ĒĢśņśĆļŗż. ņØ┤Ēøä ņ£ĪņĢłĻ▓Ćņé¼(visual inspection)ļĪ£ ņŗĀņ▓┤ ņøĆņ¦üņ×äĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņ×ĪņØīņØä ņĀ£Ļ▒░ĒĢśņśĆĻ│Ā, ļÅģļ”Įņä▒ļČäļČäņäØ(independent component analysis, ICA)ņØä ĒåĄĒĢ┤ ļłł Ļ╣£ļ╣Īņ×ä/ņóīņÜ░ ņøĆņ¦üņ×ä, ņŗ¼ņĀäļÅä(electrocardiography), ņØĖĻ│ĄņÖĆņÜ░ ņ×ĪņØī(CI artifact)ņØä ņĀ£Ļ▒░ĒĢśņśĆļŗż. Fig. 1ņŚÉ ņ×ÉĻĘ╣ņØīņØś ņĀ£ņŗ£ņŚÉ ļö░ļźĖ ņØĖĻ│ĄņÖĆņÜ░ ņ×ĪņØīņØ┤ ļéśĒāĆļé£ ĒīīĒśĢĻ│╝ ĒåĀĒżĻĘĖļלĒö╝ņŚÉ ļéśĒāĆļéśļŖö ņØĖĻ│ĄņÖĆņÜ░ Ļ┤ĆļĀ© ļīĆļćī ĒÖ£ļÅÖņä▒ņŚÉ ļīĆĒĢ£ ļīĆĒæ£ņĀüņØĖ ņśłņŗ£ļź╝ ņĀ£ņŗ£ĒĢśņśĆļŗż.
ņ×ĪņØī ņĀ£Ļ▒░(artifact rejection)Ļ░Ć ņÖäļŻīļÉ£ ļŹ░ņØ┤Ēä░ļŖö ņĀĆļīĆņŚŁ ĒåĄĻ│╝ ĒĢäĒä░(low-pass filter)ļĪ£ 20 Hz ņØ┤ņāüņØś ņŻ╝Ēīīņłśļź╝ ĒĢäĒä░ļ¦üĒĢśņśĆĻ│Ā, ņ×ÉĻĘ╣ ņŗ£ņ×æņĀÉņØĖ 0 msļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ņ×ÉĻĘ╣ ņĀä 200 msņŚÉņä£ļČĆĒä░ ņ×ÉĻĘ╣ Ēøä 1000 msĻ╣īņ¦Ć ņ┤Ø 1200 msņ£╝ļĪ£ ļČäĒĢĀ(segmentation)ĒĢśņŚ¼ ļČäņäØņŚÉ ĒÖ£ņÜ®ĒĢśņśĆļŗż. 6Ļ░Ćņ¦ĆņØś VOTs ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ ļéśļłäņ¢┤ņ¦ä ļŹ░ņØ┤Ēä░ļŖö ņĪ░Ļ▒┤ļŗ╣ ņŗżņŗ£ļÉ£ ņŗ£Ē¢ē ņłśļź╝ 63Ļ░£ņØś ņĀäĻĘ╣ ļ│äļĪ£ ĒÅēĻĘĀĒÖöĒĢśņŚ¼ ĻĖ░ņżĆ ņĀäĻĘ╣ņØś ĒÅēĻĘĀĻ░Æņ£╝ļĪ£ ļ╣╝ņŻ╝ņŚłļŗż.
ļćīĒīī ņŗĀĒśĖņøÉ ļČäņäØ(EEG source analysis)ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉ ļČäņäØ(dipole source analysis)ņØĆ BESA Research 6.0(Brain Electric Source Analysis, GmbH)ņØä ņé¼ņÜ®Ē¢łņ£╝ļ®░, HineĻ│╝ Debener [17]ņØś ļģ╝ļ¼ĖņŚÉņä£ ņäżļ¬ģĒĢ£ Ļ▓āĻ│╝ ņ£Āņé¼ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ ļČäņäØņØä ņŗżņŗ£ĒĢśņśĆļŗż. ņØ┤ ļģ╝ļ¼ĖņŚÉņä£ļŖö ļō▒Ļ░Ć ņīŹĻĘ╣ņ×É ļ¬©ļŹĖ(equivalent dipole model)ņØä ņĀüņÜ®ĒĢśņŚ¼ ņÖ╝ņ¬ĮĻ│╝ ņśżļźĖņ¬Į ļ░śĻĄ¼ņŚÉ Ļ░üĻ░ü ĒĢ£ Ļ░£ņØś ļīĆņ╣ŁņĀüņØĖ ņ£äņ╣śņŚÉ ņīŹĻĘ╣ņ×Éļź╝ ņŗ¼ņ¢┤ ņīŹĻĘ╣ņ×ÉņØś ņ£äņ╣śņÖĆ ļ░®Ē¢źņØä Ļ│äņé░ĒĢśļŖö ļ░®ņŗØņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ņ¢æņ¬Į ļ░śĻĄ¼ņØś ņīŹĻĘ╣ņ×ÉļōżņØĆ ņ▓ŁĻ░ü ņ×ÉĻĘ╣ņŚÉ Ļ░Ćņן ļ»╝Ļ░ÉĒĢśĻ▓ī ļ░śņØæĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņ¦ä ĒÜĪĒÜī(HeschlŌĆÖs gyrus, centroid, in Talairch ņóīĒæ£: ┬▒49.5, -17, 9) ĻĘ╝ļ░®ņŚÉ ļ░░ņ╣śĒĢśņśĆļŗż. ņ£äņ╣ś ņäżņĀĢņØä ņ£äĒĢ£ Talairch ņóīĒæ£ļŖö HineĻ│╝ Debener [17]ņØś ņŚ░ĻĄ¼ņŚÉņä£ ņĀüņÜ®ĒĢ£ ņóīĒæ£ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. N1ņØś ņĀäļČĆņ£äņןļĀź(global field power; GFP)ņØä ņĖĪņĀĢĒĢśņŚ¼ ņĄ£ļīĆ ņ¦äĒÅŁņØä ĒżĒĢ©ĒĢ£ 20 ms ĻĄ¼Ļ░äņØś ļŹ░ņØ┤Ēä░ļź╝ ņīŹĻĘ╣ņ×É ļČäņäØņŚÉ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ņīŹĻĘ╣ņ×É ņżæņŚÉņä£ļÅä ņĀæņäĀ(tangential) ņŗĀĒśĖņøÉņØä N1 ņīŹĻĘ╣ņ×É ļČäņäØņŚÉ ĒÖ£ņÜ®ĒĢśņśĆļŗż. ņīŹĻĘ╣ņ×ÉļōżņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö Ļ░ü ņĀäĻĘ╣ ņ▒äļäÉņØś ņĀäņ£ä ņĖĪņĀĢņ╣śņØś ņśżņ░©ļź╝ ņĄ£ņåīĒÖöĒĢśĻĖ░ ņ£äĒĢ┤ ļ¬©ļōĀ Ēö╝ĒŚśņ×ÉņŚÉņä£ 20 ms ĻĄ¼Ļ░äņØä ĻĖ░ņżĆņ£╝ļĪ£ ņĖĪņĀĢĒĢ£ ņĀüĒĢ®ļÅä(goodness of fit, GOF)Ļ░Ć 80% ņØ┤ņāüņØ┤ ļÉśļŖö ļŹ░ņØ┤Ēä░ļ¦ī ņĄ£ņóģ ļČäņäØņŚÉ ņé¼ņÜ®ļÉśņŚłļŗż. ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ ļ¬©ļōĀ Ēö╝ĒŚśņ×ÉņŚÉņä£ ĒÅēĻĘĀ ņīŹĻĘ╣ņ×É ĒīīĒśĢ(grand mean source waveform)ņØä Ļ│äņé░ĒĢśņśĆņ£╝ļ®░, ņĪ░Ļ▒┤ Ļ░äņØś ĒåĄĻ│äņĀü ņ░©ņØ┤ļź╝ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤, ņĀæņäĀ ņīŹĻĘ╣ņ×ÉņØś Ēö╝Ēü¼ļź╝ ņżæņŗ¼ņ£╝ļĪ£ ĒĢ£ 20 ms ĻĄ¼Ļ░äņŚÉņä£ņØś ĒÅēĻĘĀĻ░ÆņØ┤ ĒåĄĻ│ä ļČäņäØņŚÉ ņé¼ņÜ®ļÉśņŚłļŗż.
ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░(poor vs. good CI performers)ņØś ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØä ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ┤ ĒÄĖņ×¼ĒÖö ņ¦Ćņłś(lateralization index)ļź╝ ļŗżņØīņØś ņŗØņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ│äņé░ĒĢśņśĆļŗż.
ĒÄĖņ×¼ĒÖö ņ¦Ćņłś(lateralization index) = (contralateral-ipsilateral)/(contralateral+ipsilateral)
ĒÄĖņ×¼ĒÖö ņ¦ĆņłśļŖö -1ļČĆĒä░ +1Ļ╣īņ¦Ć ļČäĒżĒĢśļ®░, +ļŖö ļīĆņĖĪ ļ░śĻĄ¼ļĪ£ņØś ĒÄĖņĖĪņä▒ņØä ņØśļ»ĖĒĢśĻ│Ā, -ļŖö ļÅÖņĖĪņ£╝ļĪ£ņØś ĒÄĖņĖĪņä▒ņØä ņØśļ»ĖĒĢ£ļŗż.
ĒåĄĻ│ä ļ░®ļ▓ĢĒåĄĻ│ä ļČäņäØņØĆ Statistica SPSS version 12(SPSS Inc., Chicago, IL, USA) ĒöäļĪ£ĻĘĖļשņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņŗżņŗ£ļÉśņŚłļŗż. ļÅģļ”Įļ│ĆņłśļŖö 6Ļ░£ņØś VOT Ļ░ÆĻ│╝ Ēö╝ĒŚśņ×É ĻĘĖļŻ╣ņØ┤ņŚłņ£╝ļ®░, ņóģņåŹļ│ĆņłśļĪ£ļŖö x, y, z ņīŹĻĘ╣ņ×É ņ£äņ╣śņÖĆ, ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉ ĒÖ£ļÅÖņä▒ņØ┤ ņäżņĀĢļÉśņŚłļŖöļŹ░, ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņØś Ļ▓ĮņÜ░ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļŖö ļÅÖņĖĪĻ│╝ ļ░śļīĆņĖĪņØś ļīĆļćī ĒÖ£ļÅÖņä▒ņØ┤, ņĀĢņāü ņ▓ŁļĀźĻĄ░ņØĆ ņśżļźĖņ¬ĮĻ│╝ ņÖ╝ņ¬Į ļīĆļćī ĒÖ£ļÅÖņä▒ņØ┤ ņé¼ņÜ®ļÉśņŚłļŗż. ļ░śļ│ĄņĖĪņĀĢ ļČäņé░ļČäņäØ(repeated measures analysis of variance)ņØ┤ ĻĘĖļŻ╣ ļé┤ ļ│Ćņłś(6Ļ░£ņØś VOT)ņÖĆ ĻĘĖļŻ╣ Ļ░ä ļ│Ćņłś(ņÜ░ņłś CIĻĄ░, ņĀĆņĪ░ CIĻĄ░, ņĀĢņāüņ▓ŁļĀźĻĄ░)ņŚÉ ļö░ļźĖ N1 ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņŚÉņä£ņØś ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦Ć, ļśÉĒĢ£ ļ│Ćņłś Ļ░ä ņāüĒśĖņ×æņÜ®(interaction)ņØ┤ ņ׳ļŖöņ¦Ć ņĪ░ņé¼ĒĢśņśĆņ£╝ļ®░, ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ FisherŌĆÖs Least Significant Difference(LSD)ļź╝ ĒåĄĒĢ┤ ņé¼ĒøäĻ▓Ćņ”ØņØä ņŗżņŗ£ĒĢśņśĆļŗż. N1 ņīŹĻĘ╣ņ×É ņ£äņ╣śļŖö x, y, z Ļ░üĻ░üņØś ņ£äņ╣śņŚÉņä£ņØś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░Ļ│╝ ņĀĢņāü ņ▓ŁļĀźĻĄ░Ļ│╝ņØś ņ░©ņØ┤ļź╝ ļÅģļ”ĮĒæ£ļ│Ė t Ļ▓ĆņĀĢņØä ĒåĄĒĢ┤ Ļ▓Ćņ”ØĒĢśņśĆļŗż. ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņŚÉņä£ņØś ĒÄĖņĖĪ ņ¦ĆņłśņÖĆ ļ¦Éņ¦ĆĻ░üļĀźĻ│╝ņØś ņāüĻ┤ĆĻ┤ĆĻ│äļŖö ņŖżĒö╝ņ¢┤ļ¦ī ņāüĻ┤ĆĻ│äņłś(SpearmanŌĆÖs rank correlation coefficient)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ļ▓Ćņ”ØĒĢśņśĆļŗż.
Ļ▓░ Ļ│╝N1 ņīŹĻĘ╣ņ×É ņ£äņ╣śņīŹĻĘ╣ņ×É ļČäņäØ Ļ▓░Ļ│╝ ņĀĢņāü ņ▓ŁļĀź ļīĆņĪ░ĻĄ░Ļ│╝ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ ļ¬©ļæÉņŚÉņä£ 80% ņØ┤ņāüņØś ņĀüĒĢ®ļÅäļź╝ ļéśĒāĆļé┤ņŚłļŗż. Fig. 2ļŖö VOTņŚÉ ļö░ļźĖ ņĀĢļ░®Ē¢źĻ│╝ ņŚŁļ░®Ē¢źņØś ĒÅēĻĘĀ ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉ ĒīīĒśĢņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż. ņĀäņ▓┤ņĀüņ£╝ļĪ£ VOTĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ N1 ņīŹĻĘ╣ņ×É ļ░śņØæņØ┤ ņ×æņĢäņ¦ĆļŖö ĒśäņāüņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ņĀĢņāü ļīĆņĪ░ĻĄ░Ļ│╝ ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņŚÉ ļ╣äĒĢ┤ ņĀĆņĪ░ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņŚÉņä£ N1 ņŗĀĒśĖņøÉ ĒÖ£ļÅÖņä▒ņØ┤ Ļ░ÉņåīļÉ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż.
ņīŹĻĘ╣ņ×É ņ£äņ╣ś ļČäņäØ Ļ▓░Ļ│╝, ņīŹĻĘ╣ņ×É ĒĢÅ(dipole fit)ņØ┤ ņØ╝ņ░© ņ▓ŁĻ░ü ņśüņŚŁ(primary auditory cortex)Ļ│╝ ĻĘĖ ņŻ╝ļ│ĆņŚÉ ņ£äņ╣śĒĢ£ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. VOTņØś ļ│ĆĒÖöņŚÉ ļö░ļźĖ ņīŹĻĘ╣ņ×É ņ£äņ╣ś ļ│ĆĒÖöļź╝ ĒåĄĻ│äņĀüņ£╝ļĪ£ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ ņ£ĀņØśļ»ĖĒĢ£ VOT ĒÜ©Ļ│╝ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(p’╝×0.05). ĻĘĖļŻ╣ Ļ░ä ļ╣äĻĄÉļź╝ ņ£äĒĢ┤ ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×É ĻĄ░Ļ│╝ ņĀĆņĪ░ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×É ĻĄ░ņØś ņīŹĻĘ╣ņ×É ņ£äņ╣śļź╝ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ ņĀäĒøä ļ░®Ē¢ź(anterior-posterior direction; y)ņŚÉņä£ 40 msņØś VOTĻ░Ć ņ×ÉĻĘ╣ņØīņ£╝ļĪ£ ņŻ╝ņ¢┤ņĪīņØä ļĢī ļæÉ ņØĖĻ│ĄņÖĆņÜ░ ĻĘĖļŻ╣ Ļ░äņØś ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż(t=-2.62, df=18, p’╝£0.05).
N1 ņīŹĻĘ╣ņ×É ĒīīĒśĢ Ēī©Ēä┤Ļ│╝ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣Łņä▒
Fig. 3ņØĆ ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░Ļ│╝ ņĀĆņĪ░ ņé¼ņÜ®ņ×ÉĻĄ░ņŚÉņä£ņØś VOTņØś ļ│ĆĒÖöņŚÉ ļö░ļźĖ ļÅÖņĖĪĻ│╝ ļ░śļīĆņĖĪņØś ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉ ĒīīĒśĢņØś ĒÅēĻĘĀ(grand mean average)Ļ│╝, ņĀĢņāü ņ▓ŁļĀźĻĄ░ņØś ņÖ╝ņ¬ĮĻ│╝ ņśżļźĖņ¬Į ļ░śĻĄ¼ ĻĘĖļ×£ļō£ ĒÅēĻĘĀ ņŗĀĒśĖņøÉ ĒīīĒśĢņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż.
Fig. 3ņŚÉņä£ ļ│┤ņØ┤ļŖö ļ░öņÖĆ Ļ░ÖņØ┤, ņĀäņ▓┤ņĀüņØĖ N1 ņīŹĻĘ╣ņ×É ĒīīĒśĢņØś Ēī©Ēä┤ņØĆ ļ¬©ļōĀ VOTs ņĪ░Ļ▒┤ņŚÉņä£ ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØś ļÅÖņĖĪĻ│╝ ļīĆņĖĪ N1 ĒÖ£ļÅÖņä▒ ļ¬©ļæÉ ņĀĆņĪ░ ņé¼ņÜ®ņ×É ĻĄ░ņŚÉ ļ╣äĒĢ┤ ļåÆĻ│Ā, ņĀĢņāüĻĄ░ļ│┤ļŗżļŖö ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ļśÉĒĢ£ VOT ĻĖĖņØ┤ņŚÉ ļö░ļźĖ N1 ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņØś ĒÄĖņ×¼ĒÖö ņ¦ĆņłśņØś ļ│ĆĒÖöļź╝ Fig. 4ņŚÉ ņĀ£ņŗ£ĒĢśņśĆļŗż. ņĀäņ▓┤ņĀüņØĖ Ēī©Ēä┤ņØä ņé┤ĒÄ┤ļ│┤ņĢśņØä ļĢī, ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņŚÉņä£ļŖö ļ¬©ļōĀ VOT ņĪ░Ļ▒┤ņŚÉņä£ ļīĆņĖĪņØś ĒÖ£ļÅÖņä▒ņØ┤ Ēü░ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś, ņĀĆņĪ░ ĻĄ░ņŚÉņä£ļŖö 20~30 ms VOTļź╝ ņĀ£ņÖĖĒĢśĻ│Ā ļéśļ©Ėņ¦Ć VOTņŚÉņä£ļŖö ļÅÖņĖĪ ļ░®Ē¢źņ£╝ļĪ£ ĒÖ£ļÅÖņä▒ņØ┤ ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż.
VOT ĻĖĖņØ┤ņŚÉ ļö░ļźĖ N1 ņīŹĻĘ╣ņ×É ņ¦äĒÅŁĻ│╝ ņ×Āņ×¼ĻĖ░ņØś ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ļ░śļ│Ą ņĖĪņĀĢ ļČäņé░ļČäņäØņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĻĘĖļŻ╣ Ļ░ä(ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░/ņĀĆņĪ░ ņØĖĻ│ĄņÖĆņÜ░/ņĀĢņāüļīĆņĪ░ĻĄ░) ļ╣äĻĄÉņÖĆ ĻĘĖļŻ╣ ļé┤(VOTņØś ĻĖĖņØ┤: 0~50 ms) ļ╣äĻĄÉļź╝ ņŗżņŗ£ĒĢśņśĆļŗż. N1 ņīŹĻĘ╣ņ×É ņ¦äĒÅŁĻ│╝ ņ×Āņ×¼ĻĖ░ļŖö Ēö╝ĒŚśņ×ÉĻ░Ć ņ░®ņÜ®ĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ĻĖ░ņżĆņ£╝ļĪ£ ļÅÖņĖĪĻ│╝ ļīĆņĖĪņØś ņ¦äĒÅŁĻ│╝ ņ×Āņ×¼ĻĖ░ļź╝ Ļ░üĻ░ü ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, ņĀĢņāü ņ▓ŁļĀźĻĄ░ņØś Ļ▓ĮņÜ░ ņÖ╝ņ¬ĮĻ│╝ ņśżļźĖņ¬Į ļ░śĻĄ¼ņØś N1 ņīŹĻĘ╣ņ×É ņ¦äĒÅŁĻ│╝ ņ×Āņ×¼ĻĖ░ļź╝ ņĖĪņĀĢĒĢśņŚ¼ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØä ļČäņäØĒĢśņśĆļŗż. ĒåĄĻ│ä ļČäņäØ Ļ▓░Ļ│╝ ĻĘĖļŻ╣ Ļ░ä ņ░©ņØ┤ļŖö ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņŚÉ ĻĘ╝ņĀæĒĢśļéś ņ£ĀņØśļ»ĖĒĢśĻ▓ī ļéśĒāĆļéśņ¦ĆļŖö ņĢŖņĢśļŗż[F(2,17)=3.01, p=0.07]. ĒĢśņ¦Ćļ¦ī ņé¼Ēøä Ļ▓Ćņ”Ø ļČäņäØ Ļ▓░Ļ│╝ ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ĻĄ░Ļ│╝ ņĀĆņĪ░ ņØĖĻ│ĄņÖĆņÜ░ĻĄ░ņØä ļ╣äĻĄÉĒ¢łņØä ļĢī, ļīĆņĖĪņŚÉņä£ņØś N1 ņīŹĻĘ╣ņ×É ņ¦äĒÅŁņØ┤ ņ£ĀņØśļ»ĖĒĢśĻ▓ī ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(p’╝£0.05). ļśÉĒĢ£ VOT ĒÜ©Ļ│╝[F(5,40)=4.05, p<0.05]ņÖĆ VOTņÖĆ ĻĘĖļŻ╣Ļ░ä ņāüĒśĖņ×æņÜ®[F(5,40)=2.59, p<0.05] ĒÜ©Ļ│╝ ļ¬©ļæÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśļ»ĖĒĢśĻ▓ī ļéśĒāĆļé¼ļŗż. ņé¼Ēøä Ļ▓Ćņ”Ø ļČäņäØ Ļ▓░Ļ│╝, ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ĻĄ░ņØś N1 ņīŹĻĘ╣ņ×É ņ¦äĒÅŁņØ┤ 0 msĻ│╝ 10 m s VOTļ│┤ļŗż 20, 30, 40, 50 ms VOTņŚÉņä£ ņ£ĀņØśļ»ĖĒĢśĻ▓ī Ļ░ÉņåīĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(all p’╝£0.05). N1 ņ×Āņ×¼ĻĖ░ņŚÉņä£ļÅä ņ£ĀņØśļ»ĖĒĢ£ VOT ĒÜ©Ļ│╝Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░[F(5,40)=3.5, p<0.05], 50 ms VOTņŚÉņä£ņØś ļÅÖņĖĪ ņīŹĻĘ╣ņ×ÉņØś ņ×Āņ×¼ĻĖ░Ļ░Ć 10 ms VOT ļ│┤ļŗż ņ£ĀņØśļ»ĖĒĢśĻ▓ī ņ”ØĻ░ĆļÉ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(p’╝£0.05).
N1 ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒Ļ│╝ ļ¦Éņ¦ĆĻ░üļĀź Ļ░äņØś ņāüĻ┤ĆĻ┤ĆĻ│äņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś N1 ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņØś ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣Łņä▒ņØ┤ ĻĘĖļōżņØś ļ¦Éņ¦ĆĻ░ü ļŖźļĀźĻ│╝ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢśņŚ¼ 20 ms VOTņŚÉņä£ņØś N1 ņīŹĻĘ╣ņ×É ĒÄĖņ×¼ĒÖö ņ¦ĆņłśņÖĆ ņåīņØī ĒĢś ņ×ÉņØī ņ¦ĆĻ░ü Ļ▓Ćņé¼ņŚÉņä£ņØś ņłśĒ¢ēļĀźĻ│╝ņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļČäņäØĒĢśņśĆļŗż. Fig. 5ļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļōżņØś ņåīņØī ĒĢś ņ×ÉņØī ņ¦ĆĻ░ü ņĀÉņłśņŚÉ ļö░ļźĖ ĒÄĖņ×¼ĒÖö ņ¦Ćņłśļź╝ ļéśĒāĆļé┤Ļ│Ā ņ׳ļŗż. ņŖżĒö╝ņ¢┤ļ¦ī ņāüĻ┤ĆĻ│äņłś ļČäņäØ Ļ▓░Ļ│╝ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØś ĒÄĖņ×¼ĒÖö ņ¦ĆņłśĻ░Ć ņåīņØī ĒĢś ņ×ÉņØī ņ¦ĆĻ░üļĀźĻ│╝ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░(spearmanŌĆÖs rho=0.71, p’╝£0.05), ņØ┤ļŖö ņåīņØī ĒĢś ņ×ÉņØīņ¦ĆĻ░üļĀźņØ┤ ņóŗņØäņłśļĪØ ļīĆņĖĪ ļ░śĻĄ¼ņŚÉņä£ņØś N1 ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ņØśļ»ĖĒĢśļ®░, ņØ┤ņÖĆ ļ░śļīĆļĪ£ ņ¦ĆĻ░üļĀźņØ┤ ļé«ņØäņłśļĪØ ļÅÖņĖĪņØĖ ļ░śĻĄ¼ņŚÉņä£ņØś N1 ĒÖ£ļÅÖņä▒ņØ┤ ņ╗żņ¦ĆļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż.
Ļ│Ā ņ░░ļ│Ė ņŚ░ĻĄ¼ļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ£ ļīĆļćī Ļ░Ćņåīņä▒ņØä ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉ ļČäņäØņØä ĒåĄĒĢ┤ ņĢīņĢäļ│┤Ļ│Ā, ņĖĪņĀĢļÉ£ ļīĆļćī ĒÖ£ļÅÖņä▒ņØś ĒŖ╣ņä▒Ļ│╝ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ Ēøä ļ¦Éņ¦ĆĻ░üļĀźĻ│╝ņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ░ØĒ׳Ļ│Āņ×É ĒĢśņśĆļŗż. ņŚ░ĻĄ¼ Ļ▓░Ļ│╝, ļ¦Éņ¦ĆĻ░üļĀźņØ┤ ņÜ░ņłśĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØĆ ļīĆņĖĪ ļ░śĻĄ¼ņŚÉņä£ N1 ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņØ┤ ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś, ļ¦Éņ¦ĆĻ░üļĀźņØ┤ ņĀĆņĪ░ĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØĆ ņØ┤ņÖĆ ļ░śļīĆļĪ£ ļÅÖņĖĪ ļ░śĻĄ¼ņŚÉņä£ ĒÖ£ļÅÖņä▒ņØ┤ ļåÆĻ▓ī ļéśĒāĆļé¼ļŗż. ļśÉĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś N1 ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņŚÉ ļīĆĒĢ£ ĒÄĖņ×¼ĒÖö ņ¦ĆņłśĻ░Ć ņåīņØī ĒĢś ņ×ÉņØī ņ¦ĆĻ░üļĀźĻ│╝ Ļ┤ĆļĀ©ņä▒ņØ┤ Ļ╣ŖņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż.
N1 ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉņØś ņ£äņ╣śĻĘĖļŻ╣ Ļ░ä N1 ņīŹĻĘ╣ņ×ÉņØś ņ£äņ╣śļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØś N1 ņīŹĻĘ╣ņ×ÉņØś ņ£äņ╣śļŖö ņĀĆņĪ░ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņØś ņīŹĻĘ╣ņ×ÉņØś ņ£äņ╣śņÖĆ ņĀäĒøä ļ░®Ē¢źņŚÉņä£(Fig. 2) ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØĖ ļ░śļ®┤, ņĀĢņāü ņ▓ŁļĀźĻĄ░Ļ│╝ņØś ņ░©ņØ┤ļŖö ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ņÜ░ņłśĻĄ░Ļ│╝ ņĀĆņĪ░ĻĄ░ņØś ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ Ēøä ļīĆļćī ņ×¼ņĪ░ņ¦üĒÖö Ēī©Ēä┤ņØ┤ ņāüņØ┤ĒĢ£ Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż. ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ļćīņ×ÉļÅäļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ N1 ņīŹĻĘ╣ņ×É ņ£äņ╣śļź╝ ļ╣äĻĄÉĒĢ£ ņäĀĒ¢ēņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ Ēøä 2ļģäņØ┤ ņ¦Ćļé£ Ēö╝ĒŚśņ×ÉņØś N1m ņŗĀĒśĖņøÉ ņ£äņ╣śņÖĆ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉņä£ ņĖĪņĀĢĒĢ£ N1m ņŗĀĒśĖņøÉņØś ņ£äņ╣śĻ░Ć ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[18]. ĒĢ£ĒÄĖ, ņØĖĻ│ĄņÖĆņÜ░ ĒÖśņ×ÉņØś ļīĆļćī ņ×¼ņĪ░ņ¦üĒÖö ņŚ░ĻĄ¼ņŚÉņä£ļŖö N1 ņīŹĻĘ╣ņ×ÉĻ░Ć ļīĆļćī Ēö╝ņ¦łņØś ņ¢┤ļŖÉ ļČĆņ£äņŚÉ ņ£äņ╣śĒĢśļŖöņ¦ĆĻ░Ć ņżæņÜöĒĢśļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆļŗż. ņĀĢņāü ņ▓ŁļĀźņØĖņŚÉņä£ ņĖĪņĀĢļÉ£ N1 ņīŹĻĘ╣ņ×ÉņØś ņ£äņ╣śļŖö ņØ╝ņ░© ņ▓ŁĻ░ü Ēö╝ņ¦łļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŚ░ĒĢ® ņ▓ŁĻ░ü Ēö╝ņ¦łĻ│╝ Ļ░ÖņØĆ ļ╣äņØ╝ņ░© ņ▓ŁĻ░ü ļīĆļćīĒö╝ņ¦ł ļČĆņ£ä(non-primary auditory cortex)ļź╝ ĒżĒĢ©ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░[19], ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļÅä N1 ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉņØ┤ ļ╣äņØ╝ņ░© ņ▓ŁĻ░ü Ēö╝ņ¦ł ļČĆņ£äņŚÉ ņ£äņ╣śĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż[20]. ļö░ļØ╝ņä£ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ĒåĄĒĢ£ ņ▓ŁĻ░ü ņ×ÉĻĘ╣ņØś ņ×¼ņ£Āņ×ģņØĆ ņĀĢņāüņĀüņØĖ Ēī©Ēä┤ņ£╝ļĪ£ņØś ļīĆļćī ļīĆņĪ░ņ¦üĒÖöļź╝ ņĢ╝ĻĖ░ĒĢ£ļŗżĻ│Ā ļ│╝ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņ×¼ņĪ░ņ¦üĒÖöļŖö ļ¦Éņ¦ĆĻ░üļĀźņØ┤ ņóŗņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņŚÉĻ▓ī ļŹöņÜ▒ ĒśäņĀĆĒ׳ ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
N1 ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉ ĒÖ£ļÅÖņä▒Ļ│╝ ļ░śĻĄ¼ņä▒ ļ╣äļīĆņ╣Łļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļ░śĻĄ¼ņä▒ ļ╣äļīĆņ╣ŁņØś Ēī©Ēä┤ņØ┤ ļ¦Éņ¦ĆĻ░ü ņłśņżĆņŚÉ ļö░ļØ╝ ņāüņØ┤ĒĢśļŗżļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņÜ░ņłś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś Ļ▓ĮņÜ░ ņØĖĻ│ĄņÖĆņÜ░ņØś ņØ┤ņŗØ ļ░®Ē¢źņØä ĻĖ░ņżĆņ£╝ļĪ£ ļīĆņĖĪņŚÉņä£ N1 ĒÖ£ļÅÖņä▒ņØ┤ ļŹö ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś, ņĀĆņĪ░ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉĻĄ░ņŚÉņä£ņØś N1 ĒÖ£ļÅÖņä▒ņØĆ ļÅÖņĖĪņŚÉņä£ ļŹö Ēü░ Ļ▓āņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņŚÉ ļīĆĒĢ£ ņäĀĒ¢ēņŚ░ĻĄ¼ļź╝ ņé┤ĒÄ┤ļ│┤ļ®┤ ņāüļ░śļÉśļŖö Ļ▓░Ļ│╝ļź╝ ņĀ£ņŗ£ĒĢśĻ│Ā ņ׳ļŗż. 18FFDG-PETņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØä ņé┤ĒÄ┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ×ÉĻĘ╣ ņĀ£ņŗ£ ļ░®Ē¢źĻ│╝ ņāüĻ┤ĆņŚåņØ┤ ņśżļźĖņ¬Į ļ░śĻĄ¼ņŚÉņä£ ļīĆļćī ĒÖ£ļÅÖņä▒ņØ┤ ļŹö Ēü¼Ļ▓ī ļéśĒāĆļé¼ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļéś[7], ņä▒ņØĖ[17]Ļ│╝ ņĢäļÅÖ[21] ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś Ļ▓ĮņÜ░ ņÖ╝ņ¬Į ĻĘĆļĪ£ ņ×ÉĻĘ╣ņØīņØä ņĀ£ņŗ£ĒĢśņśĆņØä Ļ▓ĮņÜ░ņŚÉļ¦ī ļ░śļīĆņ¬Į ļ░śĻĄ¼ņØś ņÜ░ņäĖĻ░Ć ļŹö ļæÉļō£ļ¤¼ņ¦äļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ņāüņØ┤ĒĢ£ Ļ▓░Ļ│╝ļź╝ ņĢ╝ĻĖ░ĒĢ£ ņØ┤ņ£Ā ņżæ ĒĢśļéśļŖö ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ņä£ļĪ£ ļŗżļźĖ ņ×ÉĻĘ╣ ņĀ£ņŗ£ ļ░®Ē¢źĻ│╝ ļČäņäØ ļ░®ļ▓ĢņØä ņé¼ņÜ®Ē¢łĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĒĢśņ¦Ćļ¦ī ņĄ£ĻĘ╝ ļōżņ¢┤ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ĻĘĆļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ļīĆņĖĪĻ│╝ ļÅÖņĖĪņØś ļīĆļćī ĒÖ£ļÅÖņä▒ņØä ļČäņäØĒĢśļŖö ļ░®ļ▓ĢņØä ļ¦ÄņØ┤ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳Ļ│Ā, ņØ┤ļ¤¼ĒĢ£ ļ░®ļ▓ĢņØä ņĀüņÜ®ĒĢ£ ņŚ░ĻĄ¼ļōżņØĆ ļ╣äĻĄÉņĀü ņØ╝Ļ┤ĆņĀüņØĖ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż. ĻĘĖņżæņŚÉņä£ļÅä ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņ░®ņÜ®ĒĢ£ ņĢäļÅÖņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ĒØźļ»ĖļĪ£ņÜ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżņØ┤ ļ░£Ēæ£ļÉśņŚłļŗż. Gilley ļō▒[8]ņØĆ ļŗ©ņØīņĀł ļ¦Éņåīļ”¼ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ P1 ņīŹĻĘ╣ņ×É ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŖöļŹ░, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ ņŗ£ĻĖ░ņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ ļ¬©ļōĀ ņĢäļÅÖņŚÉņä£ ļÅÖņĖĪĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļŹö Ēü░ ļīĆņĖĪ P1 ĒÖ£ļÅÖņä▒ņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. ĒÄĖņĖĪņä▒ ņØĖĻ│ĄņÖĆņÜ░ ņĢäļÅÖņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļīĆņĖĪ ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņØ┤ ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ĒĢśņ¦Ćļ¦ī ļé©ņØĆ ĒĢ£ņ¬Į ĻĘĆņŚÉ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņØ┤ņŗØĒĢ£ ĒøäņŚÉļŖö ņØ┤ņĀäņŚÉ ļ│┤ņśĆļŹś ļīĆņĖĪņØś ĒÖ£ļÅÖņä▒ņØ┤ ņÜ░ņäĖĒ¢łļŹś ĒśäņāüņØ┤ ĒśäņĀĆĒ׳ ņżäņ¢┤ļōżĻ▒░ļéś, ļ╣äļīĆņ╣Łņä▒ņØ┤ ņé¼ļØ╝ņĀĖ ļīĆļćī ņĀäļ░śņŚÉ Ļ▒Ėņ╣£ ņīŹĻĘ╣ņ×É ĒÖ£ļÅÖņä▒ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż[4,5,21]. ļśÉ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¢æņĖĪ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ ņĢäļÅÖņØä ļīĆņāüņ£╝ļĪ£ P1 ĒÖ£ļÅÖņä▒ņØä ņĖĪņĀĢĒĢśņśĆļŖöļŹ░, ņ¢æņĖĪ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ ņĢäļÅÖņŚÉĻ▓ī ņĀĢņāü ņ▓ŁļĀź ņĢäļÅÖņŚÉņä£ ļéśĒāĆļéśļŖö ļīĆņĖĪ ļ░śĻĄ¼ ņÜ░ņäĖĻ░Ć ļéśĒāĆļé┤ņŚłņ£╝ļ®░, ļīĆņĖĪ ļ░śĻĄ¼ņØś ĒÖ£ļÅÖņä▒ņØ┤ Ēü┤ņłśļĪØ ļåÆņØĆ ļ¦Éņ¦ĆĻ░üļĀźņØä ļéśĒāĆļé┤ņŚłļŗż[4]. ņØ┤ļ¤¼ĒĢ£ ņäĀĒ¢ēņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ņÖĆ ņ£Āņé¼ĒĢśĻ▓ī, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļ¦Éņ¦ĆĻ░üļĀźņØ┤ ņÜ░ņłśĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņŚÉņä£ ļīĆņĖĪ ĒÖ£ļÅÖņä▒ņØ┤ ļåÆĻ▓ī ļéśĒāĆļé¼ļŖöļŹ░, ņØ┤ņÖĆ Ļ░ÖņØĆ ĒśäņāüņØĆ ņ£Āņ×ģļÉ£ ņ×ÉĻĘ╣ņØīņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņ▓śļ”¼ĒĢśĻĖ░ ņ£äĒĢ┤ ļīĆņĖĪ ņ▓ŁĻ░ü Ēö╝ņ¦łļĪ£ ņĀĢļ│┤ļź╝ ļ│┤ļé┤ĻĖ░ ņ£äĒĢ£ ļīĆļćīņØś ņ▒ģļץņØ┤ļ®░[22], ņØ┤ļ¤¼ĒĢ£ ļīĆļćī ņ▓śļ”¼ Ļ▓ĮļĪ£ļĪ£ ņĀĢļ│┤ņĀäļŗ¼ņØ┤ Ļ░ĆļŖźĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļōżņØś ļ¦Éņ¦ĆĻ░üļĀźņØ┤ ļŹö ņÜ░ņłśĒĢ£ Ļ▓āņ£╝ļĪ£ ņ£ĀņČöļÉ£ļŗż. ļ░śļ®┤ņŚÉ ļ¦Éņ¦ĆĻ░üļĀźņØ┤ ņĀĆņĪ░ĒĢ£ ņé¼ņÜ®ņ×ÉņØś Ļ▓ĮņÜ░ļŖö ņ▓ŁĻ░ü Ēö╝ņ¦łņØä ĒżĒĢ©ĒĢ£ ņ▓ŁĻ░ü ņżæņČöņŚÉņä£ļŖö ņĀĢļ│┤ņØś ņĀĢĒÖĢĒĢ£ ņ▓śļ”¼Ļ░Ć ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ, ņ¢æņ¬Į ļ░śĻĄ¼ļź╝ ļÅÖņŗ£ņŚÉ ņé¼ņÜ®ĒĢśĻ▒░ļéś ļīĆļćī ņĀäļ░śņŚÉ Ļ▒Ėņ╣£ ņŗĀĻ▓Į ĒÖ£ļÅÖņØä ņ£ĀļÅäĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņČöņĖĪļÉ£ļŗż. Ēś╣ņØĆ ņØĖĻ│ĄņÖĆņÜ░ņØś ļČĆņĀüņØæ(maladaptation)ņ£╝ļĪ£ ņØĖĒĢ£ ļ╣äņĀĢņāüņĀüņØĖ ļīĆļćī ņ×¼ņĪ░ņ¦üĒÖöņØś Ļ▓░Ļ│╝ļĪ£, ņĀĢņāüņĀüņØĖ ņ▓ŁĻ░ü ņ▓śļ”¼ Ļ▓ĮļĪ£ļź╝ ļ▓Śņ¢┤ļéśņä£ ļŗżļźĖ Ļ▓ĮļĪ£ļź╝ ņØ┤ņÜ®ĒĢśļŖö Ļ▓āņ£╝ļĪ£ļÅä ņČöņĖĪĒĢĀ ņłś ņ׳ļŗż[5].
ļćī ĒÖ£ļÅÖņä▒Ļ│╝ ļ¦Éņ¦ĆĻ░üļĀźņØś ņāüĻ┤ĆĻ┤ĆĻ│äļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņŚÉņä£ ļéśĒāĆļé£ ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØ┤ Ē¢ēļÅÖņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢ£ ļ¦Éņ¦ĆĻ░ü ļŖźļĀźĻ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŖöņ¦Ć ņé┤ĒÄ┤ļ│┤ĻĖ░ ņ£äĒĢśņŚ¼ ĒÄĖņ×¼ĒÖö ņ¦ĆņłśņÖĆ ņåīņØī ĒĢś ņ×ÉņØī ņ¦ĆĻ░ü ņĀÉņłśņÖĆņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņé┤ĒÄ┤ļ│┤ņĢśļŗż. ņŚ¼ļ¤¼ ļ¦Éņ¦ĆĻ░ü Ļ▓Ćņé¼ ņżæ ņåīņØī ĒĢś ņ×ÉņØīņØä ņäĀĒāØĒĢ£ ņØ┤ņ£ĀļŖö ņäĀĒ¢ēņŚ░ĻĄ¼ņŚÉņä£ ļŗżļźĖ ņóģļźś(ļ¬©ņØī, ļŗ©ņ¢┤, ļ¼Ėņן ļō▒)ņØś ļ¦Éņ¦ĆĻ░ü Ļ▓Ćņé¼ļ│┤ļŗż ņ×ÉņØī, ĒŖ╣Ē׳ ņåīņØī ĒĢśņŚÉņä£ņØś ļ¦Éņ¦ĆĻ░ü ļŖźļĀźņØ┤ ļīĆļćī ĒÖ£ļÅÖņä▒Ļ│╝ ņŚ░Ļ┤ĆņØ┤ Ļ╣ŖņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[23,24]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŗ¼ļ”¼ņØīĒ¢źĒĢÖņĀüņ£╝ļĪ£ Ļ░Ćņן ļ│Ćļ│äņØ┤ ņ¢┤ļĀżņÜ┤ 20 ms VOTņŚÉņä£ņØś N1 ņīŹĻĘ╣ņ×É ĒÄĖņ×¼ĒÖö ņ¦ĆņłśĻ░Ć ņåīņØī ĒĢś ņ×ÉņØī ņ¦ĆĻ░üļĀźĻ│╝ ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆļŖöļŹ░, ņØ┤ļŖö ņä▒ņØĖ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁĻ│╝ ļ¦Éņ¦ĆĻ░üļĀź Ļ░äņØś ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤Ļ│ĀĒĢ£ ņØ┤ņĀä ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ņÖĆ ņ£Āņé¼ĒĢśļŗż[25]. ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉļŖö Ēü┤ļ”Ł Ļ░ÖņØĆ ļŗ©ņł£ ņ×ÉĻĘ╣ņØīļ│┤ļŗż ļ¦Éņåīļ”¼ņÖĆ Ļ░ÖņØĆ ļ│ĄĒĢ®ņØīņØś ņ▓śļ”¼Ļ░Ć ņ¢┤ļĀżņÜ░ļ®░, ļ│ĄĒĢ®ņØīņØś ĒÜ©Ļ│╝ņĀüņØĖ ņ▓śļ”¼ļź╝ ņ£äĒĢ┤ Ļ░Ćņן ĒÜ©ņ£©ņĀüņØĖ ļīĆļćī ņ▓śļ”¼ Ļ▓ĮļĪ£ļź╝ Ļ░£ļ░£ĒĢśļŖö ļ░®Ē¢źņ£╝ļĪ£ ļīĆļćī ņ×¼ņĪ░ņ¦üĒÖöĻ░Ć ņŗżĒ¢ēļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[26]. ņØ┤ļ¤¼ĒĢ£ ĒĢśĒ¢ź ņĪ░ņĀł(top-down modulation) ļŖźļĀźņØ┤ ļŹö ņóŗņØĆ ņé¼ņÜ®ņ×ÉņØ╝ņłśļĪØ ņŗ£Ļ░äņĀü ņĀĢļ│┤ļź╝ ņ▓śļ”¼ĒĢśļŖö ņ▓ŁĻ░ü Ļ▓ĮļĪ£Ļ░Ć ĒŖ╣ĒÖöļÉśņ¢┤ ļŹö ņÜ░ņłśĒĢ£ ļ¦Éņ¦ĆĻ░üļĀźņ£╝ļĪ£ ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ņ£ĀņČöļÉ£ļŗż.
ņØ┤ņĀäņØś ļ¦ÄņØĆ ņäĀĒ¢ēņŚ░ĻĄ¼ņŚÉņä£ ņ▓Łņä▒ ļćīĻ░ä ļ░śņØæ, ļ│ĄĒĢ®ņŗĀĻ▓Į ĒÖ£ļÅÖņĀäņ£ä ļō▒ņØś ļŗżņ¢æĒĢ£ Ļ░ØĻ┤ĆņĀü ņĖĪņĀĢ ļÅäĻĄ¼ņÖĆ Ē¢ēļÅÖņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļ¦Éņ¦ĆĻ░üļĀź Ļ░äņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĪ░ņé¼ĒĢśņśĆņ£╝ļéś, ļæÉ ņĖĪņĀĢņ╣ś Ļ░äņØś ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ░£Ļ▓¼ĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż[27-29]. ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØ Ēøä ņØ┤ņŗØņ×ÉņØś ļ¦Éņ¦ĆĻ░ü ļŖźļĀźņØĆ ļ¦żņÜ░ ļŗżņ¢æĒĢśĻ▓ī ļéśĒāĆļéśņ¦Ćļ¦ī ņĢäņ¦üļÅä ĻĘĖ ņøÉņØĖņØĆ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņØĆ ņāüĒā£ņØ┤ļŗż. ļśÉĒĢ£ ņŻ╝Ļ┤ĆņĀü Ļ▓Ćņé¼Ļ░Ć ņ¢┤ļĀżņÜ┤ Ēö╝Ļ▓Ćņ×Éļéś ņśüņ£ĀņĢäņØś Ļ▓ĮņÜ░ Ē¢ēļÅÖņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢśļŖö ļ░®ņŗØņØś ņĀüņÜ®ņØĆ ņ×äņāüņĀüņ£╝ļĪ£ ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ ļīĆļćī Ēö╝ņ¦ł ņ£Āļ░£ ņĀäņ£äņÖĆ Ļ░ÖņØĆ Ļ░ØĻ┤ĆņĀü ņĖĪņĀĢļÅäĻĄ¼ņØś Ļ░£ļ░£ņØ┤ ņŗ£ĻĖēĒĢ£ ņŗżņĀĢņØ┤ļŗż. ļö░ļØ╝ņä£ N1 ļīĆļćī ņ£Āļ░£ ņĀäņ£äļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņØ┤ņŗØ ĒøäņØś ņØĖĻ│ĄņÖĆņÜ░ņØś ņØ┤ļōØņŚÉ ļīĆĒĢ£ ĒÅēĻ░ĆĻ░Ć Ļ░ĆļŖźĒĢśļŗżļ®┤ ņ×äņāüņĀüņ£╝ļĪ£ Ēü░ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī ņ×äņāüņĀü ņĀüņÜ®ņØä ņ£äĒĢ┤ņä£ļŖö ļŗżņ¢æĒĢ£ ņŚ░ļĀ╣ņØś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļ®░, ņśüņ£ĀņĢäļź╝ ņ£äĒĢ┤ ņŗżĒŚś ņŗ£Ļ░äņØä ļŗ©ņČĢĒĢśņŚ¼ ņĖĪņĀĢĒĢĀ ņłś ņ׳ļŖö ņŚ░ĻĄ¼ ļ░®ļ▓ĢņØ┤ Ļ░£ļ░£ļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ļ│Ė ņŚ░ĻĄ¼ļŖö ņä▒ņØĖ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņŚÉņä£ ņŗ£Ļ░ä ņĀĢļ│┤ļź╝ ĒżĒĢ©ĒĢ£ ļ¦Éņåīļ”¼ ņ×ÉĻĘ╣ņŚÉ ļö░ļźĖ ļīĆļćī ĒÖ£ļÅÖņä▒ņØś ļ│ĆĒÖöļź╝ ņīŹĻĘ╣ņ×É ņŗĀĒśĖņøÉ ļČäņäØņØä ĒåĄĒĢ┤ ņĢīņĢäļ│┤ņĢśļŗż. ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś N1 ņīŹĻĘ╣ņ×ÉņØś ļ░śĻĄ¼ņāü ļ╣äļīĆņ╣ŁņØ┤ ņ¢Ėņ¢┤ņĀü ņłśĒ¢ēļĀźĻ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņØś ĒÖĢņןĻ│╝ ņ×äņāüņĀü ņĀüņÜ®ņØä ņ£äĒĢśņŚ¼ ĒøäņåŹ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļŹö ļ¦ÄņØĆ Ēæ£ļ│ĖņłśņØś ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼Ļ░Ć ņŗżņŗ£ļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż. ļśÉĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņĀüņØæ ĻĖ░Ļ░äņŚÉ ļö░ļźĖ ļīĆļćī ĒÖ£ļÅÖņä▒ņØś ļ│ĆĒÖöļź╝ ņóģļŗ© ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņĢīņĢäļ│Ėļŗżļ®┤ ņØĖĻ│ĄņÖĆņÜ░ ņé¼ņÜ®ņ×ÉņØś ļīĆļćī ņ×¼ņĪ░ņ¦üĒÖöņŚÉ ļīĆĒĢ£ ņØ┤ĒĢ┤ļź╝ ļåÆņØ┤Ļ│Ā, ņĄ£ņĀüĒÖöļÉ£ ņ▓ŁĻ░ü ņ×¼ĒÖ£ ļ¬©ļŹĖņØä Ļ░£ļ░£ĒĢśļŖö ļŹ░ ņØ┤ļĪĀņĀüņØĖ ļÅäņøĆņØ┤ ļÉĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ACKNOWLEDGMENTSThis project was supported in part by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education (2019R1A2B5B01070129 and 2017R1D1A1B03030613) and by the Center for Women in Science, Engineering and Technology (WISET) Grant funded by the Ministry of Science, ICT & Future Planning of Korea (MSIP) under the Program for Returners into R&D (WISET-2019-252).
Fig.┬Ā1.The example of CI artifact in respond to /ba/ stimulus. The features of CI artifact are instantaneous waves with the onset of sound increased energy near CI peak topography. The VOT of sound waveform in this figure is 0 ms. Note that the CI is located at a left ear. CI: cochlear implant, VOT: voice onset time. 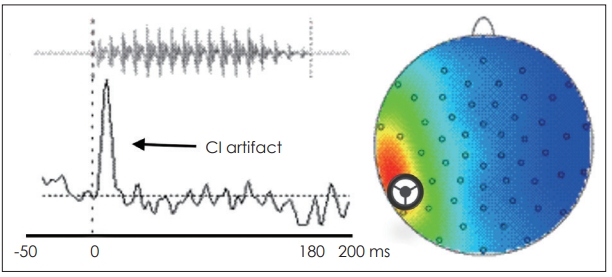
Fig.┬Ā2.N1 dipole locations for each of six VOTs in CI and NH groups. The dipoles are shown at the location of best fit in each of three views; transverse (A), coronal (B), and sagittal (C). For the CI group, individual dipoles are shown for contralateral and ipsilateral activity. Dipole fits for the NH group represent the left and the right auditory cortex. Red dots indicate HeschlŌĆÖs gyrus (Talairch coordinates: ┬▒49.5, -17, 9). CI: cochlear implant, NH: normal hearing, VOT: voice onset time. 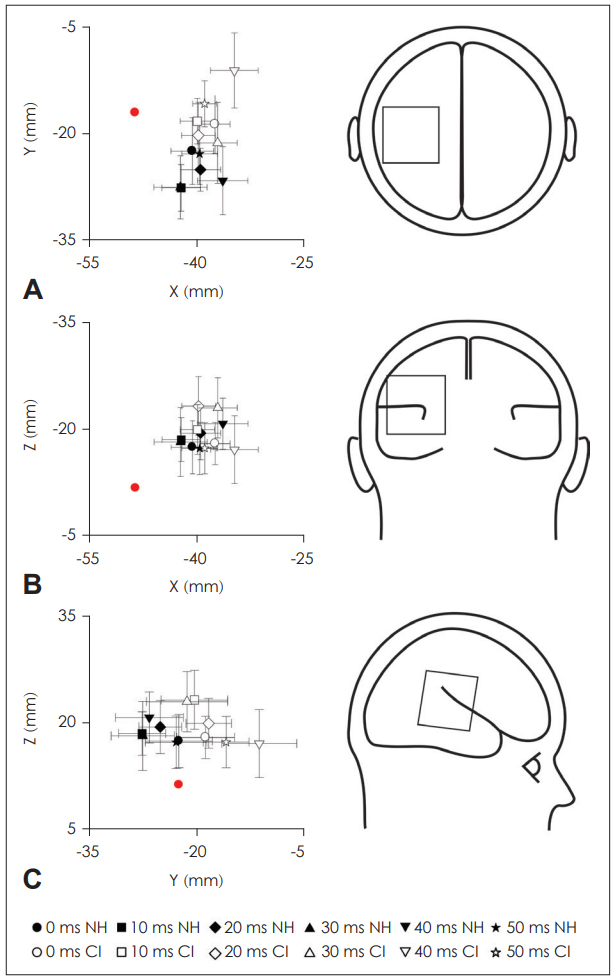
Fig.┬Ā3.Dipole source waveforms as a function of VOT. Individual waveforms represent contralateral and ipsilateral activity for Good CI performers (A), Poor CI performers (B) and NH (C) right and left auditory activity are shown. N1 source amplitude as a function of VOT (D). Black circles, blue squares, and red triangles represent NH, good CI, and poor CI groups, respectively. CI: cochlear implant, NH: normal hearing, VOT: voice onset time. 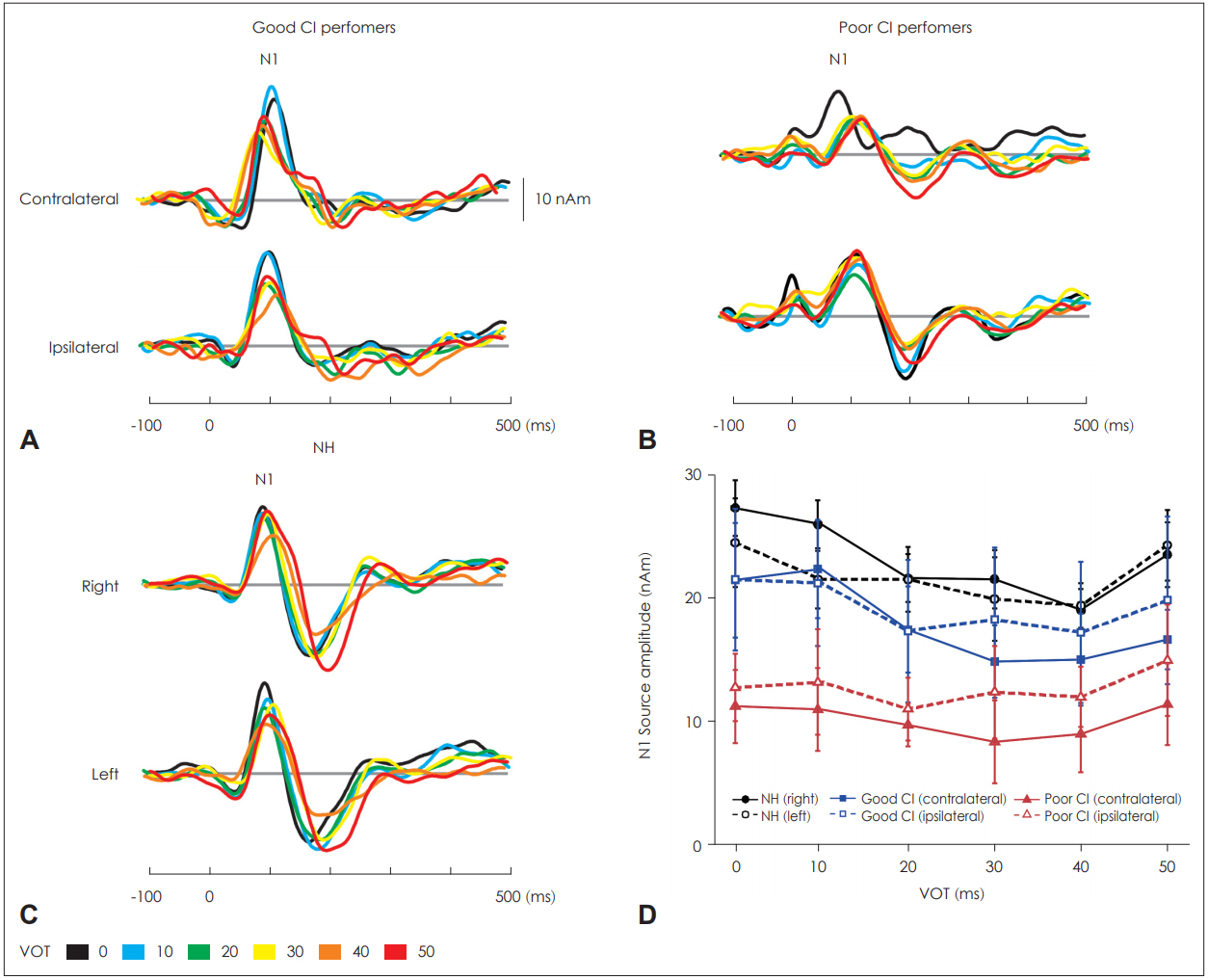
Fig.┬Ā4.Lateralization index as a function of VOT in good and poor CI groups. Note that a plus (+) in lateralization index means the contralateral dominance while a minus (-) indicates the ipsilateral dominance. CI: cochlear implant, VOT: voice onset time. 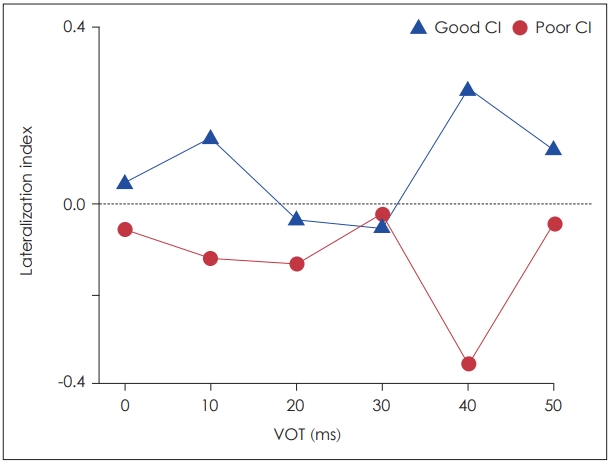
Fig.┬Ā5.Relationship between LI for N1 dipole source amplitudes and consonant in noise perception in CI users. The LIs for N1 dipole source amplitude at 20 ms VOT were positively related to consonant in noise scores in CI users (r=0.71, p<0.05). CI: cochlear implant, LI: lateralization index. 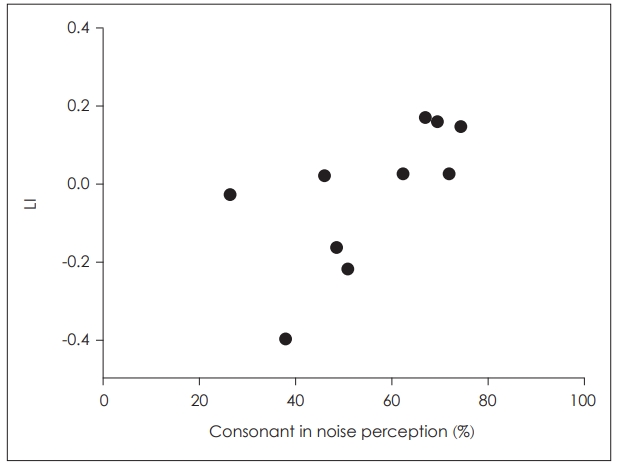
Table┬Ā1.Demographics of the adult CI recipients Table┬Ā2.Summary of the different types of speech perception scores for the CI users REFERENCES1. Giraud AL, Price CJ, Graham JM, Frackowiak RS. Functional plasticity of language-related brain areas after cochlear implantation. Brain 2001;124(Pt 7):1307-16.
2. Debener S, Hine J, Bleeck S, Eyles J. Source localization of auditory evoked potentials after cochlear implantation. Psychophysiology 2008;45(1):20-4.
3. Pantev C, Ross B, Berg P, Elbert T, Rockstroh B. Study of the human auditory cortices using a whole-head magnetometer: Left vs. right hemisphere and ipsilateral vs. contralateral stimulation. Audiol Neurootol 1998;3(2-3):183-90.
4. Gordon KA, Wong DDE, Papsin BC. Bilateral input protects the cortex from unilaterally-driven reorganization in children who are deaf. Brain 2013;136(Pt 5):1609-25.
5. Jiwani S, Papsin BC, Gordon KA. Early unilateral cochlear implantation promotes mature cortical asymmetries in adolescents who are deaf. Hum Brain Mapp 2016;37(1):135-52.
6. Lazard DS, Lee HJ, Truy E, Giraud AL. Bilateral reorganization of posterior temporal cortices in post-lingual deafness and its relation to cochlear implant outcome. Hum Brain Mapp 2013;34(5):1208-19.
7. Kang E, Lee DS, Lee JS, Kang H, Hwang CH, Oh SH, et al. Developmental hemispheric asymmetry of interregional metabolic correlation of the auditory cortex in deaf subjects. Neuroimage 2003;19(3):777-83.
8. Gilley PM, Sharma A, Dorman MF. Cortical reorganization in children with cochlear implants. Brain Res 2008;1239:56-65.
9. Doucet ME, Bergeron F, Lassonde M, Ferron P, Lepore F. Crossmodal reorganization and speech perception in cochlear implant users. Brain 2006;129(Pt 12):3376-83.
10. Hauthal N, Sandmann P, Debener S, Thome JD. Visual movement perception in deaf and hearing individuals. Adv Cogn Psychol 2013;9(2):53-61.
11. Picton TW. Human auditory evoked potential. 1st ed. San Diego, CA: Plural Publishing Inc; 2011. p. 1-634.
12. Wolpaw JR, Wood CC. Scalp distribution of human auditory evoked potentials. I. Evaluation of reference electrode sites. Electroencephalogr Clin Neurophysiol 1982;54(1):15-24.
13. Dimitrijevic A, Pratt H, Starr A. Auditory cortical activity in normal hearing subjects to consonant vowels presented in quiet and in noise. Clin Neurophysiol 2013;124(6):1204-15.
14. Sharma A, Dorman MF. Cortical auditory evoked potential correlates of categorical perception of voice-onset time. J Acoust Soc Am 1999;106(2):1078-83.
15. Iverson P. Evaluating the function of phonetic perceptual phenomena within speech recognition: An examination of the perception of /d/-/t/ by adult cochlear implant users. J Acoust Soc Am 2003;113(2):1056-64.
16. Park JH, Han JH. Behavioral perception and neural correlates of categorical perception in cochlear implant users. Korean J Otorhinolaryngol-Head Neck Surg 2018;61(1):15-23.
17. Hine J, Debener S. Late auditory evoked potentials asymmetry revisited. Clin Neurophysiol 2007;118(6):1274-85.
18. Pantev C, Dinnesen A, Ross B, Wollbrink A, Knief A. Dynamics of auditory plasticity after cochlear implantation: A longitudinal study. Cereb Cortex 2006;16(1):31-6.
19. Pantev C, Bertrand O, Eulitz C, Verkindt C, Hampson S, Schuierer G, et al. Specific tonotopic organizations of different areas of the human auditory cortex revealed by simultaneous magnetic and electric recordings. Electroencephalogr Clin Neurophysiol 1995;94(1):26-40.
20. Sharma A, Gilley PM, Dorman MF, Baldwin R. Deprivationinduced cortical reorganization in children with cochlear implants. Int J Audiol 2007;46(9):494-9.
21. Yamazaki H, Easwar V, Polonenko MJ, Jiwani S, Wong DDE, Papsin BC, et al. Cortical hemispheric asymmetries are present at young ages and further develop into adolescence. Hum Brain Mapp 2018;39(2):941-54.
22. Kral A, Sharma A. Developmental neuroplasticity after cochlear implantation. Trends Neurosci 2012;35(2):111-22.
23. Han JH, Zhang F, Kadis DS, Houston LM, Samy RN, Smith ML, et al. Auditory cortical activity to different voice onset times in cochlear implant users. Clin Neurophysiol 2016;127(2):1603-17.
24. Kelly AS, Purdy SC, Thorne PR. Electrophysiological and speech perception measures of auditory processing in experienced adult cochlear implant users. Clin Neurophysiol 2005;116(6):1235-46.
25. Sandmann P, Eichele T, Buechler M, Debener S, J├żncke L, Dillier N, et al. Evaluation of evoked potentials to dyadic tones after cochlear implantation. Brain 2009;132(Pt 7):1967-79.
26. Kral A, Eggermont JJ. WhatŌĆÖs to lose and whatŌĆÖs to learn: Development under auditory deprivation, cochlear implants and limits of cortical plasticity. Brain Res Rev 2007;56(1):259-69.
27. Abbas PJ, Brown CJ. Electrically evoked auditory brainstem response: Refractory properties and strength-duration functions. Hear Res 1991;51(1):139-47.
|
|
|||||||||||||||||||||||||||||||||||||||

 |
 |