노쇠 정도를 통한 두경부 암환자의 진단 및 치료 방향 결정에 관하여
Determination of Diagnosis and Treatment for Head and Neck Cancer Patients Considering Frailty
Article information
Trans Abstract
As population ages, much more elderly patients have been diagnosed with head and neck cancer especially in Korea. Diverse factors such as comorbidities and disabilities make the establishment of evidence-based guidance more challenging. Chronological age, literally measured in days, months and years from the time the individual was born, is not an ideal predictor in determining personal health condition; individualization of treatment protocols with identifying the concept of frailty is the key to produce an advanced treatment plan of elderly patients suffering from head and neck malignancy. Frailty is a type of geriatric syndrome which refers to the status with age-associated declines in physiologic function and increased vulnerability to stress conditions independent of age. Therefore, screening the status of frailty may be beneficial for the elderly patients to determine decent treatment option and maximize the efficiency. In order to provide otolaryngologists prognostic information adapting the concept of frailty, research papers published from 2000 to 2018 are comprehensively reviewed in this article. For optimal care of elderly patients with head and neck cancer, frailty is definitely required to be assessed in order to establish an ideal treatment option and increase the efficacy of the treatment.
서 론
우리나라의 인구 고령화는 선진국에서도 경험하지 못한 속도로 빠르게 진행되고 있어 노쇠가 임상적으로 중요한 문제로 대두되고 있으며, 인구의 고령화로 인하여 노인 환자에서의 두경부암 진단도 늘어나고 있다. 노인이 가지고 있는 동반질환, 장애, 다양한 투약력, 인지력 및 사회적 이슈 등의 요인으로 인하여 그들을 치료하는 것은 쉽지 않은 문제이다. 이들 노인 환자의 치료와 관련된 주된 치료 패러다임의 변화 중 하나는 그 동안 전반적인 건강 상태와 암 치료에 있어 불량한 예후로 여겨지는 절대적인 나이만을 고려한 치료 프로토콜에서 개별화된 치료 접근으로의 변화이다.
건강한 환자와 노쇠한 환자를 구분하는 것은 개개인에 따른 예후 정보를 분석하여 치료계획을 세우는데 있어 핵심적 단계이다. 나이와 무관하게 노쇠는 복잡한 노인성 증후군으로, 외부 스트레스에 대한 저항력이나 예비 여력이 감소하여 여러 생리적인 체계의 누적된 쇠퇴를 가져오고 작은 충격에 의해서도 합병증에 이환되기 쉬운 상태라고 할 수 있다. 이는 기존의 다양한 연구를 통해 수술을 받는 암환자에 있어 수술후의 결과 및 치료 결정에 다양한 영향을 미치는 것으로 알려져 있다. 더욱이 노쇠 정도를 파악함으로써 환자 개개인에 대한 포괄적 평가를 통해 보다 나은 결과를 얻기 위한 조기 치료 방침의 결정도 가능하다. 특히 노인 두경부암 환자는 흡연 및 음주와 관련된 위험 요소와 밀접한 관련이 있으며, 상부 기도 및 위장관의 기능에 영향을 미치는 부위에 종양이 발생하기 때문에 이에 따른 특징적 취약성을 보인다. 연하과 호흡의 기능 장애는 연하 곤란, 영양 실조 및 흡인을 야기하여 악액질, 치과적 질환, 알코올 중독 및 경제적 스트레스로 인해 불량한 건강상태로 고통 받는 사람들에게 추가적인 위험 요인으로 작용한다. 따라서 고령의 두경부암 환자의 위험 요소 파악 및 치료 계획 수립에 있어 노쇠를 확인하고 평가하는 것은 필수적이다.
본 론
노쇠: 개념과 유병률
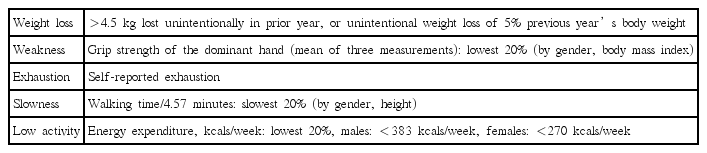
노쇠는 점차로 고령 환자의 건강 상태를 독립적으로 결정하는 요인으로 인식되고 있으며, 동반질환 및 장애와는 별개 또는 중복되는 요소로 고려되기도 한다. 노쇠의 정의와 관련하여 추가적인 합의가 필요하나, 이 증후군(일련의 징후)의 개념은 이미 확립되어있다. 노쇠는 개인의 힘, 지구력 및 신체적 능력이 감소됨으로써 적응력이 감소되고 허약함이 증가된 의학적 조건으로 특징지어진다[1]. 노쇠해지는 위험성이 있는 노인을 묘사하기 위해 노쇠징후(prefrailty)란 단어를 사용하기도 한다. 또한 인구의 고령화로 인하여 노쇠한 상태에 놓여 있는 사람이 점차로 늘고 있다. 65세 이상의 인구에서 노쇠가 있는 사람의 비율은 약 10% 정도이며, 나이가 증가함에 따라 85세 이상의 인구에서는 25~50%까지 증가한다[2,3]. 암 그 자체뿐 만 아니라 치료와 관련된 생리학적 요소와 연관되어 암 환자들에게서 더 높은 수준의 노쇠가 확인되었으며 약 42% 정도로 추정 된다[4]. 지금까지 노쇠의 가설과 관련하여 두개의 서로 다른 문헌 보고가 있다. Fried 등[5]은 노화와 관련된 세포 및 생리학적인 변화가 신체의 체계(systemic process) 및 항상성의 손상을 야기하여 노쇠가 나타난다고 주장하였다. Cardiovascular Health Study에 따르면 노쇠는 신체적으로 느끼는 피로감, 의도되지 않은 체중 감소, 약화된 악력, 느린 보행 속도, 저하된 신체 활동 중 3개 이상이 존재할 때로 정의하고 있다(Table 1). 이런 노쇠 증상의 발현은 수술과 관련하여 가장 많이 사용되는 노쇠 측정 도구 중 하나이며 널리 검증된 방법이다[6-8]. 또한 Rockwood 등[9]에 의해 개발된 결함의 축적 이론에 따르면 의료, 사회, 기능 등의 다양한 방면에서 여러 기능이 손실되면 노쇠가 보다 증가하게 된다고 설명하고 있다. 누적 결함 노쇠 지수(Frailty Index of Accumulative Deficits, FI-CD)는 최대 92개의 변수를 평가한 후 모든 변수의 합계를 총 변수의 가지 수로 나누어 산출하는 지수이다. 이 지수에 따르면 증가된 결함의 누적 효과에 따라 노쇠 정도가 증가한다는 것이 확인되었다. 평가를 위해 필요한 변수의 가짓수가 상당하기 때문에 modified Frailty Index(mFI)라 하는 수정본이 개발되었는데 이는 노쇠 지수의 임상적 활용도를 향상시키기 위해 기존보다 적은 수의 변수만으로 평가한다[10].
노쇠의 진단
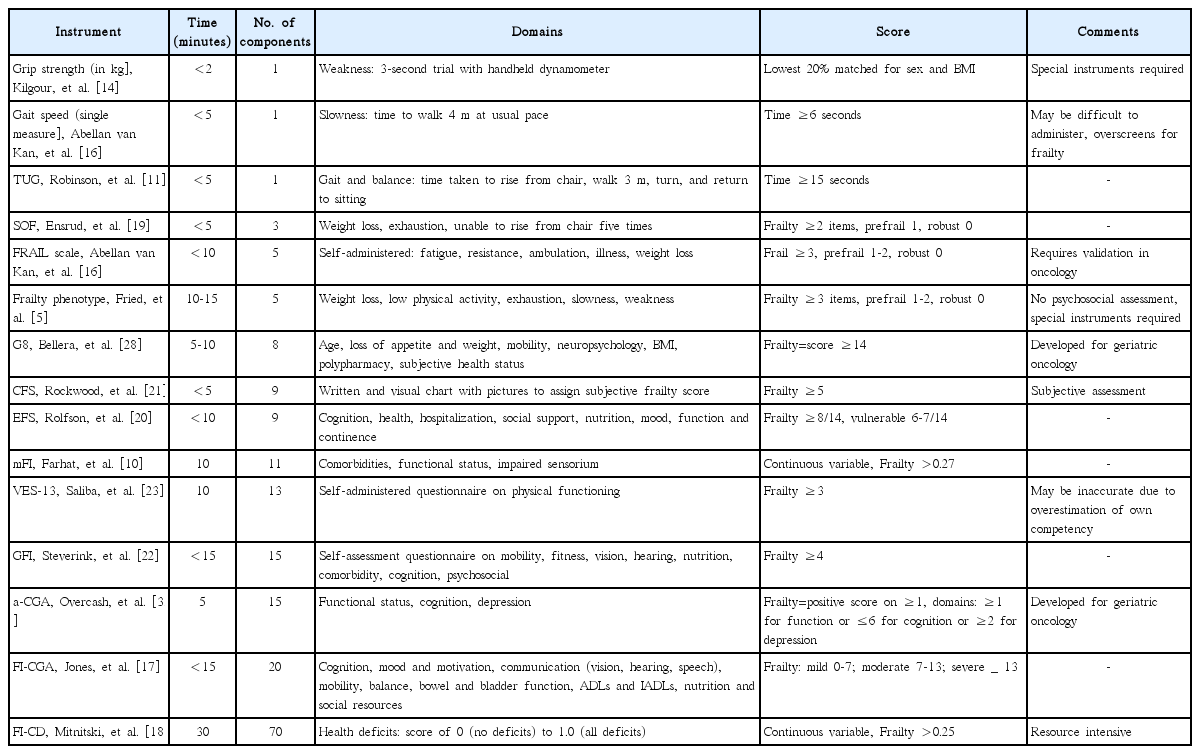
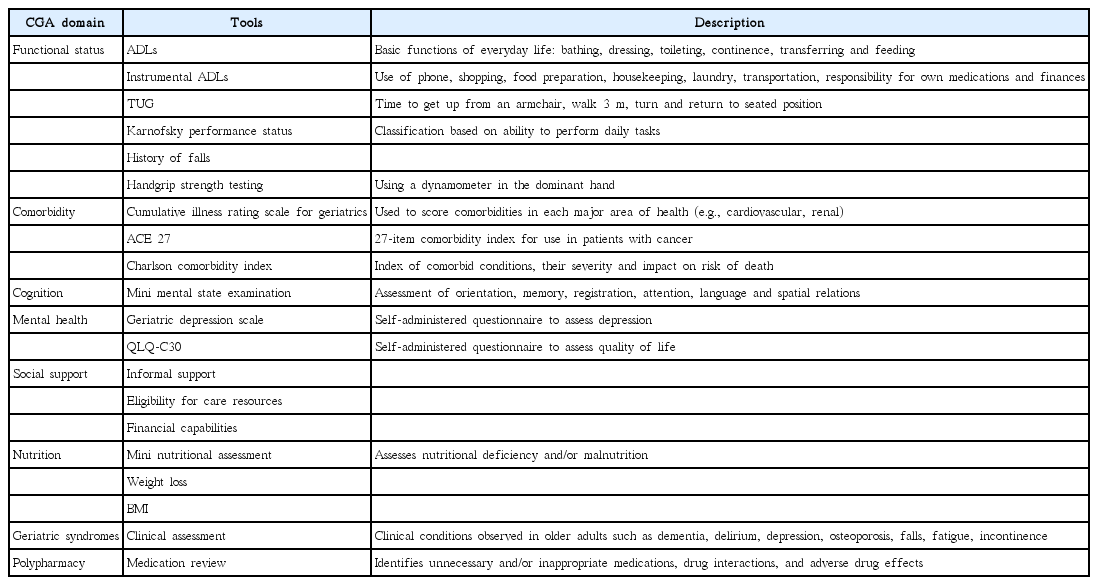
노쇠의 진단을 위한 70개 이상의 평가 방법이 문헌에 기술되어 있으나 대부분이 충분히 검증되어있지 않으며 이들 방법의 대부분은 앞서 기술된 노쇠 표현형(frailty phenotype) 또는 노쇠 지수에서 유래된 것이다. 이들 방법은 의도된 목적에 따라 상이하고, 연구 환경에서 사용할 목적으로 개발된 경우도 많으며, 선별의 목적에서부터 임상적 중재를 위한 목적의 것까지 다양하다. 또한 제한된 지역, 입원환자 혹은 수술적 치료를 받는 환자 등과 같이 특정 대상만을 위한 평가가 많기 때문에 일반화된 사용에는 주의가 필요하다. 이 방법들은 Fried 등[5]이 제시 한 보행속도, 악력 등과 같이 노쇠를 대변하는 단일 항목을 통한 평가에서부터 신체적, 기능적, 인지적 측면을 토대로 점수를 매기는 정교하고 광범위한 방법까지 다양하다. 임상적으로 적용 가능한 이상적인 평가 방법 여부는 평가가 필요한 임상적 상황 및 필요성, 제한된 시간 내에 시행 가능성 여부 등에 달려있다. 위험 요소의 계층화는 단일 평가를 통해 용이하게 이루어 질 수 있다. 5 m의 거리를 걷는데 걸리는 시간을 측정한 보행속도와 Time Up and Go 점수는 높은 이환율과 사망률의 예측 인자로 확인되었다[11-13]. 마찬가지로 handheld dynamometer를 통해 측정된 악력은 암환자의 합병증 및 생존율과 관련이 있다[14,15]. 보다 다양한 요소, 방법, 측정범위, 대상을 포함하는 정교한 측정 도구로서 FRAIL Index [16], Comprehensive Geriatric Assessment(CGA)에서 유래된 Frailty Index [17], FI-CD [18], Study of Osteoporotic Fractures Index [19], Edmonton Frail Scale [20], Clinical Frailty Scale [21], Groningen Frailty Indicator [22] 및 Vulnerable Elders Survey(VES-13) [23] 등이 개발되어 있다(Table 2). 그러므로 이러한 다양한 측정 도구의 비교 연구를 통해 폭넓은 합의가 필요한 것은 당연하다[24]. 방대한 자료를 통한 노쇠의 총합을 기반으로 하는 방법이던, 노쇠의 신체적인 면만을 기반으로 하는 방법이던지 간에 노쇠 평가 방법은 지속적으로 논란이 되는 주제로 남아있다. 그러나 임상적으로 어떤 형태의 평가를 사용할지에 대하여 불량한 검사 결과가 노쇠에 대하여 일관적인 결과를 보여주기 때문에 이미 어느 정도의 합의는 이루어져 있다. CGA는 노인 환자에 있어 노쇠 평가의 표준이 되고 있다. 이는 환자의 의학적, 기능적, 심리적, 인지적, 그리고 사회적 안녕 측면을 포함하는 표준화되고 검증된 평가 방법이다(Table 3). 또한 CGA의 사용은 생존율, 신체 기능의 향상 및 일반적 의학 상담으로는 확인하기 어려운 노쇠의 확인에 도움을 주기 때문에 International Society of Geriatric Oncology 및 National Comprehensive Cancer Network으로부터 추천되고 있다[25,26]. 전체 CGA를 도입하는 것은 시간과 노력을 필요로 하며, 의료 전문가와 노인 보건팀 사이의 협력을 통한 다양한 접근을 요하기 때문에 CGA가 널리 이용되는 데에 방해요소가 되고 있다. 이 문제를 해결하기 위하여 일차적으로 정확하게 노쇠 환자를 구분하고, 이차적으로 이들로 하여금 CGA 검사를 받도록 하여 표준화된 치료를 가능하도록 해주는 다양한 선별검사들이 고안되었다. 위에서 언급된 다양한 노쇠 평가 도구들 역시 이러한 목적을 위해 다방면으로 검증되었다[27]. 이 검사들의 목적은 보다 효과적이고 객관화된 평가의 제공에 있다. 따라서 이러한 접근법은 추가적인 평가가 필요한 환자를 선별함에 있어 충분한 민감도를 가지고 불필요한 검사를 하지 않도록 충분한 특이도를 보여야 하지만, 현재까지 이 목표에 도달하는 단일 검사법은 없다.
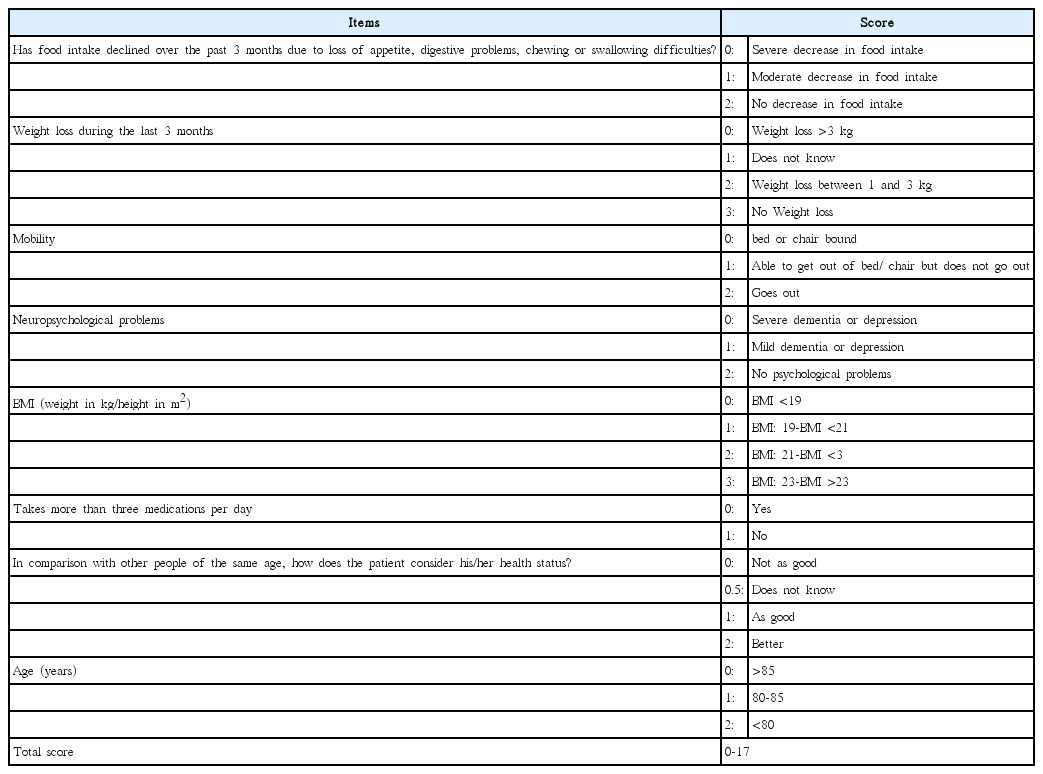
현재까지 고령의 종양환자에게 사용이 가능하도록 고안된 타당성이 확인되고 특성화된 검사는 거의 없다. 문헌상으로 가장 많이 연구된 검사법은 2012년도에 Bellera 등[28]에 의해 개발된 Geriatric 8(G8)이며, 이 검사는 8가지 평가 요소로 구성되어 있다: 한가지 요소는 나이와 관련이 있으며, 나머지 7가지는 Table 4에 해당하는 Mini Nutritional Assessment로부터 적용하였다(Table 4). 각 점수는 가장 허약한 상태인 0점부터 매우 건강한 상태인 17까지로 구성되며, 14점을 기준으로 추가적 CGA 검사 진행 여부가 결정된다. 검사 시간은 평균 5분 정도이며, 간호사를 비롯한 여타의 검사자에 의해 시행이 되며 다양한 연구를 통하여 검증이 된 검사법이다. Kenis 등[29]은 70세 이상에서 새롭게 암으로 진단된 937명의 환자를 대상으로 G8의 타당성 및 예후 결정의 유용성을 확인하였다. G8 검사는 CGA를 통해 결정된 노쇠 환자와 비교하여 86.5%의 양성 예측도를 보였으며 61.3%의 음성 예측도를 보였다. 더욱이 G8은 환자의 기능 상실 및 전체 생존율 면에 있어 의미 있는 예후 결과를 보여주었다. 또한 CGA, G8 및 VES-13을 가지고 다양한 암을 가진 1325명의 환자를 평가하는 대규모의 다기관 연구가 진행되었고 그 결과 G8의 민감도와 특이도는 각각 76.5%와 64.4%로 확인되었으며, 1년 생존율에 대한 개별 예후인자로 적합한 검사로 보고되었다[30]. 그 밖의 다양한 연구에서 G8의 민감도는 CGA로 평가한 결과와 비교하여 65~92%정도의 민감도를 보이는 것으로 보고하였고, 대다수에서 80% 이상으로 확인되었으며, 특이도는 40~75%로 보고되었다[31-34]. 또한 간소화된 abbreviated CGA(aCGA)는 정형화된 평가가 필요한 노인성 종양학 분야의 선별 검사 수단으로 고안되었으며 G8과는 대조적으로 aCGA는 97%의 높은 특이도를 보였으며 민감도는 상대적으로 낮은 51%를 보여 이에 상응하는 목적으로 주로 사용된다[35,36].
노쇠와 암
이질적인 고령의 암 환자군에서 최적의 치료 계획을 세우는 것은 다소 어려운 문제일 수 있다. 그들이 가지고 있는 여러 방면의 취약성으로 인해 악성 종양의 치료 계획을 수립하는데 있어 이완된 장기 및 연령에 기반을 두는 전통적인 접근 방식은 제한 점이 있다. 응급수술부터 계획된 수술에 이르기까지 환자의 노쇠는 술 후 합병증, 사망률, 입원기간 및 퇴원 후 계획을 포함한 전반적인 수술의 불량한 결과에 영향을 미친다[37]. 종약학적으로 불량한 수술 결과는 다양한 암으로 수술을 받는 환자의 노쇠 상태와 연관이 있는 것으로 나타났다[7,8,38-57]. 또한 노쇠는 항암치료 및 방사선치료에 대한 환자의 내성과도 관련이 있으며, 나아가 치료 후 부작용 발생 및 삶의 질 저하를 유발하는 것으로 알려져 있다. 결과적으로 치료에 대한 순응 불량 및 중단은 건강 관리(비용)의 증가와 암 치료의 위축으로 이어진다[58,59]. 이러한 목적과 관련하여 조사한 연구에 따르면 노쇠의 평가는 항암치료의 부작용과 치료 중단의 가능성 측면에 대해 일반적으로 사용되는 신체 활동 점수와 비교하여 보다 우수한 예측 결과를 보여주는 것으로 나타났다[60,61]. 유방암 환자군을 대상으로 시행한 연구에서 Fried 노쇠 점수(Fried frailty score)와 암 특이적 CGA 검사를 통해 방사선 치료로 발생하는 신체 위약성을 예측할 수 있음이 확인되었다[62]. 이러한 노쇠 평가는 건강한 노인 환자를 확인하여 젊은 환자와 비슷한 항암치료 결과를 이끌어내는데 중요한 역할을 하며, 노쇠를 가진 노인 환자에서 노인학 전문가가 개입하도록 하여 보다 나은 치료 결과를 기대할 수도 있다[63]. 노쇠의 진단은 그 자체가 치료방향에 미치는 영향뿐만 아니라, 다학제적 치료팀으로 하여금 어떠한 추가적 노력이 필요한지에 대한 정보를 제공해주는 중요한 역할을 한다. 다양한 종류의 암을 가진 1967명의 노인 환자군를 포함하는 대규모 전향적 다기관 연구를 통해 CGA가 치료 결정에 미치는 영향이 조사되었다. 해당 연구에서 치료를 담당하는 의사의 설문 조사 결과에 따르면 노쇠 평가 결과가 25.3%의 사례에서 치료 결정에 영향을 미친 것으로 나타났다[64]. 그 밖의 여러 소규모 연구에서도 비슷한 결과를 보였으며, 고령 암환자의 20~49%의 경우에서 이를 통해 치료 방침이 변경되었다고 보고하고 있다[65,66]. 치료 강도에 미치는 영향을 보고한 연구에서는 90% 이상의 경우에서 치료 강도를 낮추게 되었다는 결과가 보고되었다. 더욱이 평가가 시행된 환자의 26~83%에 해당하는 대부분의 경우에서 노쇠로 인한 개입이 발생하였으며, 이들을 위한 지원 방법으로 사회적 지지, 약물적 및 영양 측면의 지원이 시행되었다.
노쇠와 두경부암
비록 과거에는 환자의 연령 및 동반질환 여부가 환자의 위험성을 판단하기 위한 주된 요소로 사용되었으나, 최근에는 노인 두경부암 환자의 노쇠 평가가 널리 보급되고 임상적 실체로 인식이 바뀌고 있다. Pottel 등[34]은 두경부암 환자 중 CGA를 기준으로 단독 방사선치료를 시행 받은 환자의 68.6%, 항암방사선 동시 치료를 받은 환자의 72%에서 노쇠가 확인되었다고 보고하였다[67]. 이들 중 가장 흔하게 노쇠가 확인된 영역은 동반질환(77~84.3%)과 영양결핍(49~49%)이었다. 이러한 결과는 수술적 치료 혹은 비수술적 치료를 받은 두경부암 환자 모두를 대상으로 포함한 연구 결과와는 다소 차이를 보였다. 대한이비인후과학회의 Kwon 등[68]에 의한 연구결과 43.6%의 환자에서 노쇠가 있다고 보고하였고, 두경부의 피부암과 타액선암이 포함된 환자군을 통한 Bras 등[69]의 보고에 따르면 약 40%에서 노쇠의 동반을 보고하였다. 이와 같은 상이한 결과는 연구 대상, 노쇠의 평가 방법, 선택 편향(selection bias) 등의 요인에 의해 설명될 수 있으며, 수술적 치료를 받은 환자군 보다는 방사선 치료를 받은 환자군에서 더 과장되어 나타날 수 있다. 노쇠와 관련된 일반적인 문헌들이 고령의 두경부암 환자에서 적용될 수도 있겠지만, 연하곤란이나 호흡곤란과 같이 종양이 기관 및 식도에 위치하여 발생하는 특징적 사항들로 인하여 보다 명확한 근거를 통한 고려가 필요하다. 두경부암 환자는 종양의 물리적 영향과 이에 따른 항암 또는 방사선 치료로 인한 영향에 의해 연하장애 및 호흡곤란에 특히 취약하다. 구강, 구인두, 하인두, 그리고 후두의 종양은 통증, 폐색 혹은 연하기전의 부조화로 인한 섭식 감소와 기도 흡인을 조장할 수 있다[70]. 또한 항암 및 방사선치료 도중에 발생되는 점막염, 구강건조증, 미각장애, 오연 및 식욕부진으로 인해 더 큰 영양 문제가 야기될 수 있다. 이러한 문제에 보다 빠르게 접근하는 것은 음식물 섭취 및 영양상태를 개선시키고 치료 전 노쇠를 최적화 시키는 조치를 가능하게 하여 적절한 시기에 치료를 시작하는데 도움이 될 수 있다[71].
두경부암 환자에서의 노쇠의 선별
두경부암 환자군에서 흔히 사용되는 검사 도구의 타당성을 입증하기 위한 두 연구가 기존에 시행되었다. 한 대규모의 전향적 다기관 연구에서는 노쇠 환자를 선별하기 위한 도구로서의 ONCODAGE의 타당성을 평가하였고[30], 또 다른 연구에서는 CGA 검사 시행이 필요한 환자의 선별 및 1년 생존율의 예후 확인 수단으로서의 G8의 검증이 시행되었다. 두경부 암환자의 소그룹 분석에서 G8은 노쇠를 판단하는데 있어 94.1%의 민감도와 83.3%의 특이도(양성 예측도: 98.5%, 음성 예측도: 55.6%)의 결과를 나타냈다. 또한 동반된 항암치료 여부와 상관 없이 치료적 목적의 1차 또는 추가 방사선 치료를 받은 환자군에서 G8과 VES-13을 평가하기 위한 예비연구를 통해 두 가지 검사 모두 양호한 진단적 가치가 확인되었다[34]. VES-13은 민감도와 특이도가 각각 57.1%와 100%로 확인되었고, G8의 경우 85.7%의 민감도와 75%의 특이도를 보였다. 더욱이 두 검사의 조합을 통해 보다 향상된 진단적 효용성이 확인되었다. G8은 두경부암 환자에서 흔히 발생하는 영양과 관련된 부분에 더 많은 가중치를 두었기 때문에 보다 우수성이 있을 것으로 사료된다. 이는 질량 효과가 큰 진행된 병기에서 보다 높은 연하장애가 발생하며, 이 환자들에서 보다 높은 노쇠가 확인되는 경향성에 의해 뒷받침된다. 이 때문에 상부 기관식도의 질환으로 인한 고유한 예후 인자를 확인하여 고령의 두경부암 환자군에 적용 가능한 새로운 선별평가 도구를 고안하려는 노력이 진행되고 있다. Kwon 등[68]은 호흡 및 후두 기능의 지표로 삼기 위해 CGA 평가 항목에 1초당 노력성 호기 용적 및 voice handicap index(VHI)를 함께 추가하였고, 삼킴 기능을 평가하기 위해 MD Anderson Dysphagia Inventory(MDADI) 및 videofluoroscopic swallow studies 점수를 추가하였다. 또한 저작이나 삼킴에 미치는 문제를 파악하고자 치과적 접근을 하였다. CGA는 2년 이환율과는 관계가 없는 것으로 밝혀졌기에 삼킴과 호흡 기능을 측정하는 지표를 활용한 9개의 측면을 포함하는 두경부암 특이적 선별 도구를 개발했으며, 이는 이환율과 사망률의 예측에 영향을 미친다는 것이 밝혀졌다. 불량한 결과와 관련된 것으로 알려진 독립적인 요인들이 있는데 이는 75세 이상의 고령, 심각한 흡연, 체중감소, Eastern Cooperative Oncology Group status ≥2, Charlson Comorbidity Index ≥1, 치과적 문제, VHI ≥8, MDADI <70, 그리고 Beck Depression Inventory ≥14이다. 이를 토대로 점수가 5~9에 해당하는 고위험군은 2년 이환율 및 사망률 면에서 보다 높은 위험성을 보였다.
두경부암 환자의 노쇠와 치료 결과
두경부암 환자에 있어 노쇠는 불량한 치료 결과, 건강과 관련된 삶의 질 및 치료 부작용 등과 밀접한 관련이 있는 것으로 알려져 있다. 다양한 두경부암으로 수술을 받은 환자를 대상으로 환자의 노쇠 여부 및 이와 관련된 진단 및 치료 결과의 상관성 확인을 위한 연구가 시행되었다. 그 결과 환자의 7.4%에서만 노쇠가 있는 것으로 확인되었으나, 환자의 노쇠는 수술 후 부작용, 약물 합병증, 원내 사망, 입원 기간 그리고 입원 비용과 밀접한 상관관계가 있는 것으로 드러났다[72]. Abt 등[73]은 두경부 수술을 받은 환자 1192명의 술 후 결과를 mFI를 이용하여 후향적으로 분석하였다. 위약성이 있다고 판단되는 환자에서 전반적인 이환율과 사망률의 증가를 보였으며, 특히 의도하지 않았던 추가적 수술 등을 포함한 술 후 합병증에 유의미한 영향을 미침이 확인되었다. 또한 하위그룹 분석에서 하악절제술, 설절제술, 후두절제술을 시행 받은 환자의 경우 mFI 점수가 증가함에 따라 Clavien-Dindo grade IV에 해당하는 심각한 합병증의 발생의 유의미하게 증가하였다. Kwon 등[68]은 수술적 또는 비수술적 치료를 받은 두경부암 환자를 대상으로 CGA를 통해 진단된 노쇠와 2년 사망률과의 관계를 분석하였으나 특별한 상관관계는 확인되지 않았다. 그 밖에 Pottel 등[34]은 수술을 받지 않은 두경부 환자군에서 G8 결과가 36개월 생존율의 독립적 예측 인자임을 보고하였다[67]. 또한 이들은 건강과 관련된 삶의 질이나 치료 독성 측면에 대한 추적 연구를 추가적으로 시행하였다[74]. 그 결과에 노쇠가 있는 환자는 항암화학요법 동반여부와 무관하게 방사선치료 전/도중/후 모두에서 삶의 질 점수가 지속적으로 낮게 유지되는 것이 확인되었다. 또한 치료 전 CGA에서 비정상으로 확인된 영역의 수와 삶의 질 사이의 상관관계 역시 확인되었다. 고령의 환자에서도 치료가 끝남과 동시에 삶의 질 점수가 치료 전과 유사한 상태로 돌아가나, 노쇠가 동반된 환자의 경우 치료 전과 비슷하게 돌아가기 까지는 5개월 정도가 소요됨이 확인되었다. 추가적인 분석에서 노쇠한 환자는 그렇지 않은 사람과 비교하여 유의하게 기능 점수는 낮았고 증상 점수는 높았다. 이 데이터들은 수명보다는 삶의 질에 더 가치를 두는 노쇠가 있는 환자에서 치료 방법을 설명할 때 치료 부작용 및 기대 여명과 관련된 균형성이 반드시 설명되어야 함을 강조한다. 또한 방사선 치료를 받는 두경부암 환자의 연속적 CGA와 치료 독성과의 상관성과 관련된 연구가 같은 저자들에 의해 시행되었다[74]. 비록 노쇠한 환자의 경우 더 심한 독성 및 입원 경향이 있음이 밝혀졌으나, 모든 환자에서 G8을 기준으로 주로 영양과 관련된 측면에서의 취약성이 치료 도중 발생함이 확인되었는데, 이 결과 역시 구강의 기능이 노쇠에 중요한 요소임이 강조되는 부분이다.
결 론
인구의 고령화와 함께 노년층에서 확인되는 노쇠는 증가하고 있다. 여러 연구의 결과에서 일반인 뿐만 아니라 암 환자군에서 노쇠는 여러 종류의 불량한 결과 및 예후와 관련됨이 보고되고 있다. 두경부암 환자에서 노쇠가 갖는 중요성을 완전하게 이해하기 위해서는 보다 많은 연구가 필요하다. 비록 CGA가 노쇠 진단을 위한 표준 검사로 알려져 있으나, G8 역시 임상에서 효과적으로 시행 가능하고 다양한 이질적 환자군의 개별화된 치료 예후 판단에 도움을 주는 실용적이고 객관적인 검사 도구이다. 따라서 두경부 영역의 진단 및 치료를 결정할 때 객관적인 나이만을 기준으로 하지 말고 G8 등 노쇠를 평가 할 수 있는 도구들의 사용을 강력히 권장하며, 이를 통해 두경부 질환 환자들의 문제 해결에 필요한 판단 증거 및 최적화된 치료의 개발이라는 궁극적 목표에 접근할 수 있는 새로운 지평을 열어줄 것으로 사료된다.
Acknowledgements
No financial or material support has been received for this work; moreover, the authors declare no financial interests in companies or other entities that may be interested in the results of this study.