ņä£ ļĪĀ
ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£Īņóģ(deromatofibrosarcoma protuberans)ņØĆ ņ¦äĒö╝ņÖĆ ņ¦Ćļ░®ņĪ░ņ¦üņŚÉ Ļ▒Ėņ│É ņä¼ņ£ĀņĢäņäĖĒżĻ░Ć ĒīīĻ┤┤ņä▒ņ£╝ļĪ£ ņ”ØņŗØļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ļō£ļ¼Ė ņóģņ¢æņ£╝ļĪ£ ņŚ░ņĪ░ņ¦ü ņ£ĪņóģņØś 5% ļ»Ėļ¦ī, ļæÉĻ▓ĮļČĆ ņ£ĪņóģņØś 4~10%ļź╝ ņ░©ņ¦ĆĒĢśļŖö ņĀĆļō▒ĻĖēņØś Ēö╝ļČĆņ£ĪņóģņØ┤ļŗż[1]. 30~40 ņäĖņŚÉ ĒśĖļ░£ĒĢśĻ│Ā, ļé©ņä▒ņŚÉņä£ 7:3ņØś ļ╣äņ£©ļĪ£ ļ¦Äļŗż. ļæÉĒö╝ņŚÉ Ļ░Ćņן ļ¦ÄņØ┤ ļ░£ņāØĒĢśĻ│Ā, ĻĘĖ ņÖĖ ņĢłļ®┤ļČĆĻ│╝ Ļ▓ĮļČĆņŚÉ ļ░£ņāØĒĢ£ļŗż[2].
ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņØĆ ļČēņØĆņāēņØ┤ļéś ņ▓ŁņāēņØä ļØĀĻ│Ā ņåÉĻ░ĆļØĮņ£╝ļĪ£ ļłäļź┤ļ®┤ ņ░Įļ░▒ĒĢ┤ņ¦ĆļŖö, ņ£ĄĻĖ░ļÉśĻ│Ā Ļ▓ĮĒÖöļÉ£ ļ¼┤ĒåĄņä▒ņØś ĒīÉ ļśÉļŖö Ļ▓░ņĀłļĪ£ ļéśĒāĆļé£ļŗż. ĻĄŁņåīņ×¼ļ░£ļźĀņØ┤ ļ¦żņÜ░ ļåÆņØĆ ļ░śļ®┤, ņøÉĻ▓®ņĀäņØ┤ļŖö ņĢäņŻ╝ ļō£ļ¼╝Ļ│Ā ņ▓£ņ▓£Ē׳ ņ×ÉļØ╝ĻĖ░ ļĢīļ¼ĖņŚÉ ņ¦äļŗ©ņØ┤ ļŖ”ņ¢┤ņ¦ĆĻ│Ā Ļ▓░ņĀł ĒśĢĒā£ļź╝ ļ│┤ņØ┤ļ»ĆļĪ£ ņ╝łļĪ£ņØ┤ļō£, ĻĖ░ņĀĆņäĖĒżņĢö, Ēö╝ļČĆĻ▓ĮĒÖöņ”Øņ£╝ļĪ£ ņśżņ¦ä ļÉśĻĖ░ ņēĮļŗż[3]. ĻĘĖ Ļ▓░Ļ│╝ Ļ▓ĮļČĆņŚÉņä£ ļ░£ņāØĒĢśļŖö Ļ▓ĮņÜ░ļŖö ļŗ©ņł£ ņ¢æņä▒ņóģņ¢æņ£╝ļĪ£ ņāØĻ░üĒĢśĻ│Ā ņĀüņĀłĒĢ£ ņ╣śļŻīņŗ£ĻĖ░ļź╝ ļåōņ╣śĻĖ░Ļ░Ć ņēĮļŗż.
ļ│Ė ņ”ØļĪĆļŖö ļŗ©ņł£ ņ╝łļĪ£ņØ┤ļō£ļĪ£ ņ¦äļŗ©ļÉśĻ│Ā ņ╣śļŻīļ░øņØĆ ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£Īņóģ ņ”ØļĪĆļź╝ Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
ņ”Ø ļĪĆ
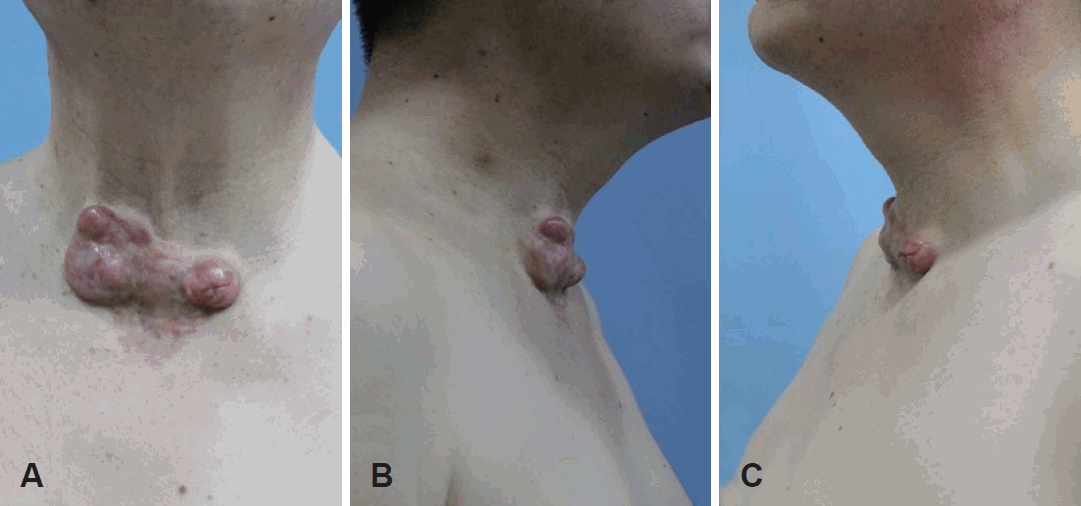
63ņäĖ ļé©ņ×É ĒÖśņ×ÉĻ░Ć ļé┤ņøÉ 8ļģä ņĀäļČĆĒä░ ņä£ņä£Ē׳ ņ╗żņ¦ĆļŖö Ļ▓ĮļČĆ ņĀäĒĢśļ░®ņóģļ¼╝ņØä ņŻ╝ņåīļĪ£ ļ│ĖņøÉ Ēö╝ļČĆĻ│╝ņŚÉ ļé┤ņøÉĒĢśņśĆļŗż. ĒÖśņ×ÉļŖö Ļ│╝Ļ▒░ļĀźņāü ļŗ╣ļć©ļ│æņ£╝ļĪ£ Ēł¼ņĢĮ ņżæņØ┤ņŚłņ£╝ļ®░ 10ņŚ¼ ļģä ņĀäņŚÉ ņĀäĻ▓ĮļČĆņŚÉ ņ×æņØĆ ņāüņ▓śļź╝ Ļ▓ĮĒŚśĒĢ£ ņØ╝ņØ┤ ņ׳ņŚłļŗż. ņŗĀņ▓┤Ļ▓Ćņé¼ņāü Ļ▓ĮļČĆ ņĀäĒĢśļ░® ļČĆņ£äņŚÉ ņĢĮ 8├Ś4 cm Ēü¼ĻĖ░ņØś ļ¼┤ĒåĄņä▒ņØ┤ļ®░ ļŗ©ļŗ©ĒĢ£ ņóģĻ┤┤Ļ░Ć ņ┤ēņ¦ĆļÉśņŚłļŗż(Fig. 1).
ņ¦ĆņåŹņĀüņØĖ Ēö╝ļČĆĻ│╝ņĀü ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņóģļ¼╝ņØĆ ņĀÉņĀÉ ņ╗żņĀĖ ļ│ĖņøÉ ņä▒ĒśĢņÖĖĻ│╝ņŚÉ ņØśļó░ļÉśņŚłļŗż. ĒÖśņ×ÉņØś Ļ│╝Ļ▒░ ļ│æļĀźĻ│╝ Ļ▓ĮĒŚśņāü ņ╝łļĪ£ņØ┤ļō£(Keloid)ļĪ£ ņØśņŗ¼ļÉśņ¢┤ ņóģļ¼╝ņĀłņĀ£ Ēøä Ēö╝ļČĆ ņØ┤ņŗØņØä ĒåĄĒĢ£ ņ×¼Ļ▒┤ņØä Ļ│äĒÜŹĒĢśņśĆļŗż. ņłśņłĀ ņĀä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮļČĆņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņĪ░ņśüņ”ØĻ░ĢņØ┤ ļÉśļŖö 8├Ś4 cmņØś ņóģļ¼╝ņØ┤ Ļ▓ĮļČĆ ņĀäĒĢśļ░®ļČĆņŚÉ ņ׳ņŚłĻ│Ā ņÜ░ņĖĪ Ēö╝ļīĆĻĘ╝(strap muscle)ņ£╝ļĪ£ ņ╣©ņ£żņØ┤ ņØśņŗ¼ļÉśņŚłņ£╝ļéś ņ╝łļĪ£ņØ┤ļō£ļĪ£ ņØśņŗ¼ĒĢśĻ│Ā ņØ┤ņŚÉ ļīĆĒĢ£ ņČöĻ░Ć ĒÅēĻ░ĆļŖö ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢśļŗż(Fig. 2).
ņä▒ĒśĢņÖĖĻ│╝ņŚÉņä£ ņóģļ¼╝ ņĀłņĀ£ņāØĻ▓ĆņØä Ļ│äĒÜŹĒĢśņśĆĻ│Ā ņĀäņŗĀļ¦łņĘ©ĒĢśņŚÉ ņóģļ¼╝ņØä ņĀłņĀ£ĒĢśņśĆĻ│Ā, ņłĀ ņżæ ņŗ£Ē¢ēĒĢ£ ļÅÖĻ▓░ņĀłĒÄĖ ļ│æļ”¼Ļ▓Ćņé¼Ļ▓░Ļ│╝ ņ£Īņóģ(sarcoma)ņ£╝ļĪ£ ņØśņŗ¼ļÉśļŖö Ļ▓░Ļ│╝ļź╝ ļ░øņĢśļŗż. ĻĘĖļ¤¼ļéś ņä▒ĒśĢņÖĖĻ│╝ņŚÉņä£ļŖö ņ╝łļĪ£ņØ┤ļō£Ļ░Ć ļäłļ¼┤ļéśļÅä ĒÖĢņŗżĒĢ┤ ļ│┤ņśĆĻ│Ā, ļÅÖĻ▓░ņĀłĒÄĖ ļ│æļ”¼ Ļ▓Ćņé¼ Ļ▓░Ļ│╝Ļ░Ć ĒÖĢņŗżĒĢ£ ņ£Īņóģņ£╝ļĪ£ ĒÖĢņ¦äĒĢĀ ņłś ņŚåĻĖ░ņŚÉ, ņČöĒøä ņĢģņä▒ ņ¦äļŗ©ņØ┤ ļé┤ļĀżņ¦Ćļ®┤ ņČöĻ░Ć ņłśņłĀņØä Ļ│ĀļĀżĒĢśĻ│Ā ņĀłņĀ£ ļČĆņ£äņŚÉ ļīĆĒĢ£ ņ×¼Ļ▒┤ ņŚåņØ┤ ĻĘĖļīĆļĪ£ ņłśņłĀņØä ļ¦łņ│żļŗż(Fig. 3). ņØ┤Ēøä ņĪ░ņ¦ü ņāØĻ▓ĆņŚÉņä£ ņ£ĄĻĖ░ņä▒Ēö╝ļČĆņä¼ņ£Āņ£Īņóģ(deromatofibrosarcoma protuberans)ņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłļŗż. ņĪ░ņ¦üĻ▓Ćņé¼ņāü ņ¦äĒö╝ņĖĄņØś ļ░®ņČöĒśĢ ņäĖĒż(spindle cell)Ļ░Ć ļéśņäĀĒśĢņ£╝ļĪ£ ļ░Ćņ¦æļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░ ĒĢĄņØś ļŗżĒśĢņä▒(nuclear pleomophism)ņØ┤ļéś ņ£Āņé¼ļČäņŚ┤ņØĆ Ļ▒░ņØś Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 4A). ļ®┤ņŚŁņĪ░ņ¦üĒÖöĒĢÖņĀü Ļ▓Ćņé¼ņŚÉņä£ CD34ņŚÉ ņ¢æņä▒ ļ░śņØæņØä ļ│┤ņØĖ ļ░śļ®┤(Fig. 4B), CD31, smooth muscle actin(SMA), S-100 protein ņŚÉļŖö ņØīņä▒ ļ░śņØæņØä ļ│┤ņŚ¼ ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņŚÉ ĒĢ®ļŗ╣ĒĢ£ ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż(Fig. 4C and D). ņŗ¼ļČĆ ļ░Å ņÖĖņĖĪ ņĀłņĀ£ņŚ░ņŚÉņä£ ņĢģņä▒ņäĖĒżĻ░Ć ļ░£Ļ▓¼ļÉśņŚłĻ│Ā Ļ┤æļ▓öņ£äņĀłņĀ£ņÖĆ Ē¢źĒøä ņ╣śļŻī ņ£äĒĢ┤ ņØ┤ļ╣äņØĖĒøäĻ│╝ņŚÉ ņØśļó░ļÉśņŚłļŗż.
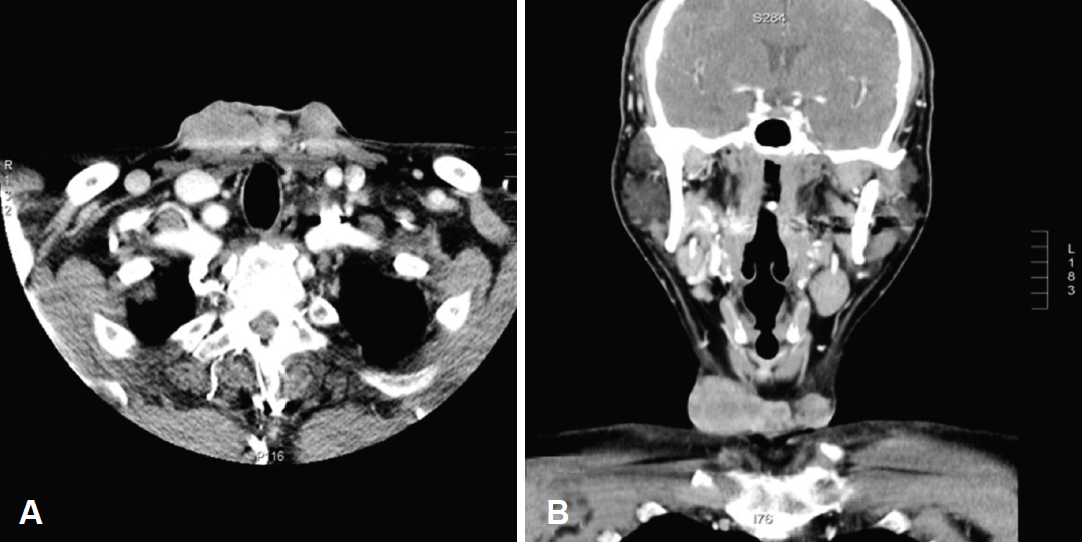
ņØ┤ļ╣äņØĖĒøäĻ│╝ņĀü Ļ▓Ćņé¼ņŚÉļŖö ĒŖ╣ņØ┤ņåīĻ▓¼ņØ┤ ņŚåņŚłņ£╝ļ®░ Ļ▓ĮļČĆ CT, MRI ņŚÉņä£ ĒŖ╣ļ│äĒĢ£ ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņ¢æņĀäņ×Éļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ļŖö ņłśņłĀņŚÉ ņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØ┤ļŖö Ēæ£ņżĆņäŁņĘ©Ļ│äņłś 2.8ņØś Ļ│╝ļīĆņé¼ ļ│æļ│Ćļ¦ī Ļ┤Ćņ░░ļÉśņŚłļŗż. Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņØĆ ņĀłņĀ£ļČĆņ£äņŚÉņä£ ņ×ÉņŻ╝ ņ×¼ļ░£ĒĢśļŖö ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ä ņóģņ¢æņØ┤ļ»ĆļĪ£ ņĄ£ņ┤łņØś CT ņåīĻ▓¼ņØä ĻĖ░ņżĆņ£╝ļĪ£ ņóģņ¢æņŚÉņä£ 3 cmņØś ņĀłņĀ£ņŚ░ņØä ļæÉĻ│Ā ņóģņ¢æņØä ņĀ£Ļ▒░ĒĢśļŖö Ļ│äĒÜŹņØä ņäĖņøĀņ£╝ļ®░, ņ¢æņĖĪ Ēö╝ļīĆĻĘ╝(strap muscle), ĒØēņćäņ£ĀļÅīĻĘ╝(sternocleidomastoid muscle)ņØś ļé┤ņĖĪļČĆņ£ä, ņ¢æņĖĪ Ļ░æņāüņäĀņØś ļé┤ņĖĪļČĆņ£ä ļ░Å ĒśæļČĆ(isthmus)ļČĆņ£äļź╝ ņĀłņĀ£ĒĢśņśĆļŗż. ņØ┤ņ¢┤ ņ¢æņĖĪ Ļ▓ĮļČĆ level III, IV, VI ļ”╝ĒöäņĀł Ļ│Įņ▓ŁņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 5). ļÅÖĻ▓░ņĀłĒÄĖ Ļ▓░Ļ│╝ ņĀłņĀ£ņŚ░ņØśņÖĖņĖĪ, ņāüļČĆ, ĒĢśļČĆ ļ░Å ņŗ¼ļČĆņĀłņĀ£ņŚ░ņŚÉņä£ ņĢģņä▒ņäĖĒżļŖö ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż.
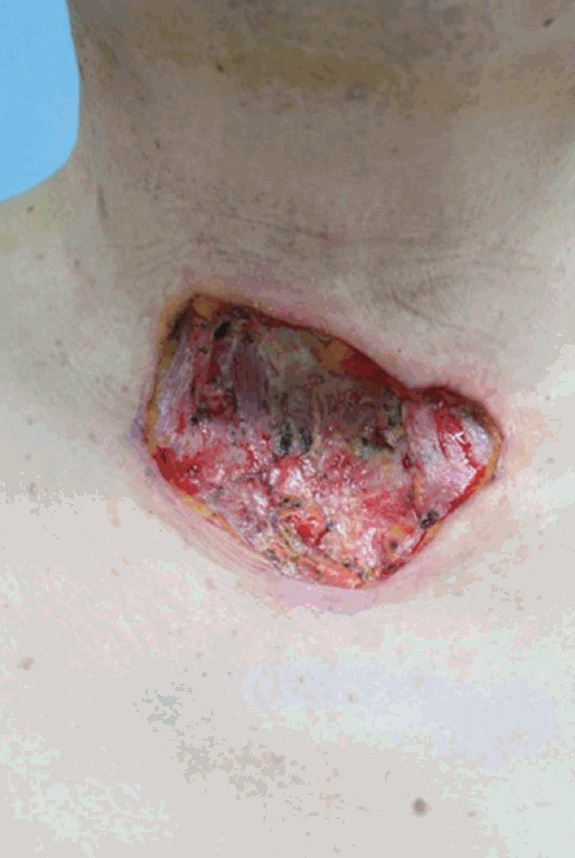
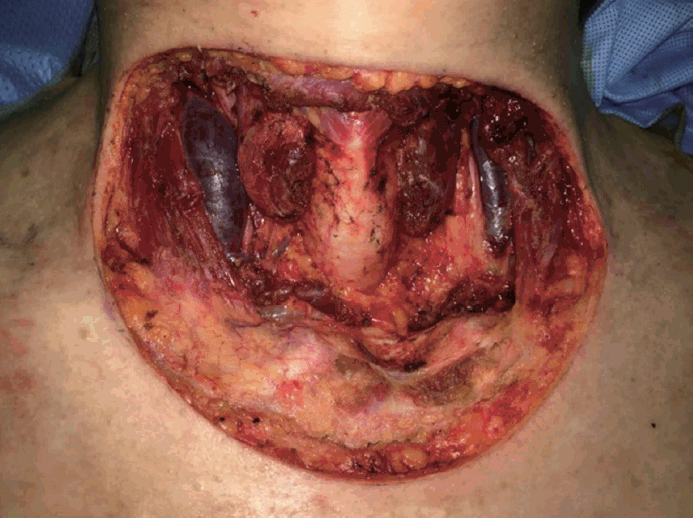
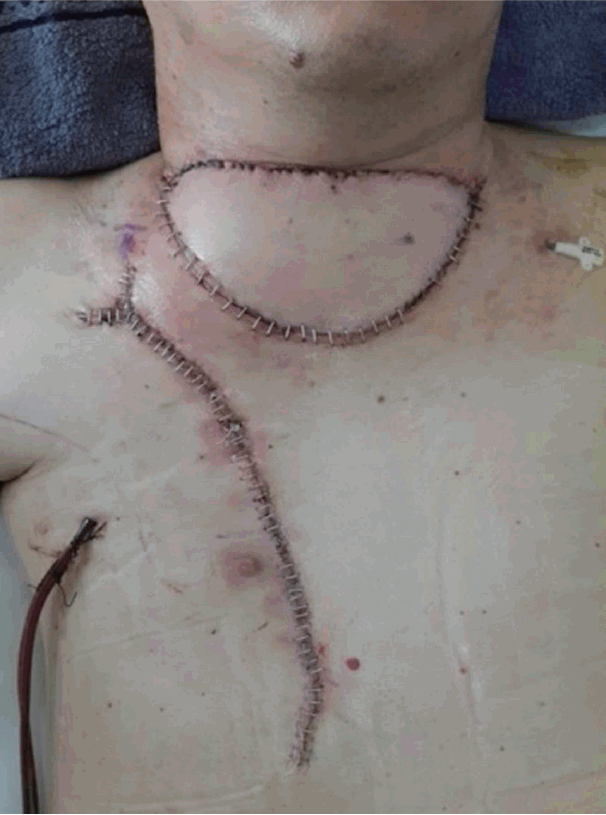
ņØ┤Ēøä ļīĆĒØēĻĘ╝Ēö╝ĒīÉ(pectoralis major myocutaneous flap)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ▓░ņåÉļČĆņ£äļź╝ ņ×¼Ļ▒┤ĒĢśņśĆļŗż(Fig. 6). ĻĄŁņåī ņ×¼ļ░£ņØ┤ ļ¦ÄņØĆ ņóģņ¢æņØ┤ĻĖ░ņŚÉ ņ×¼ļ░£ ļ░®ņ¦Ćļź╝ ņ£äĒĢ┤ ļ░®ņé¼ņäĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ ņÖĖļל Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ Ļ▓░Ļ│╝ ņłśņłĀ Ēøä 3Ļ░£ņøöņØ┤ ņ¦Ćļé£ Ēśäņ×¼Ļ╣īņ¦Ć ņ×¼ļ░£ņØś ņ”ØĻ▒░ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖĻ│Ā ņ׳ļŗż.
Ļ│Ā ņ░░
ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņØĆ ļ╣äĻĄÉņĀü ļō£ļ¼Ė ņżæļō▒ļÅäņØś ņĢģņä▒ ņóģņ¢æņ£╝ļĪ£ 0.5 cmņŚÉņä£ļČĆĒä░ 20 cmņŚÉ ņØ┤ļź┤ĻĖ░Ļ╣īņ¦Ć ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ļĪ£ ļ│┤Ļ│Ā ļÉśļ®░, ņĀäņ▓┤ ņóģņ¢æņØś 0.1% ņØ┤ĒĢśļź╝ ņ░©ņ¦ĆĒĢ£ļŗż[4]. ņ”ØņāüņØĆ ņŻ╝ņ£ä Ēö╝ļČĆņØś ļ¬©ņäĖĒśłĻ┤ĆĒÖĢņןņ”ØņØ┤ ļÅÖļ░śļÉ£ ļČäĒÖŹņāēņØś ĒīÉ(plaque)ĒśĢĒā£ļĪ£ ņŗ£ņ×æĒĢśņŚ¼ Ļ▓░ņĀł(nodule)ņØś ĒśĢĒā£ļĪ£ ņä▒ņןĒĢ£ļŗż. ņä£ņä£Ē׳ ņ×ÉļØ╝ĻĖ░ ļĢīļ¼ĖņŚÉ ņ¦äļŗ©ļÉśĻĖ░Ļ╣īņ¦Ć ļīĆļČĆļČä ņśżļ×£ ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ļÉ£ļŗż[5].
ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņØś ļ│æņØĖņØĆ ĒÖĢņŗżĒ׳ ņĢī ņłś ņŚåņ£╝ļéś ņÖĖņāüņØś Ļ▓ĮļĀźņØä 10~20%ņŚÉņä£ ņ░ŠņĢäļ│╝ ņłś ņ׳ņ£╝ļ®░[6], ĒÖöņāüņØä ņ×ģņØĆ ļČĆņ£äļéś ņłśņłĀ Ēøä ļ░śĒØöņĪ░ņ¦üņŚÉņä£ ņØ┤ ņóģņ¢æņØ┤ ļ░£ņāØļÉśņŚłļŗżļŖö ļ│┤Ļ│ĀļōżņØ┤ ņ׳ļŗż[7]. ļö░ļØ╝ņä£ ņ╝łļĪ£ņØ┤ļō£ņÖĆ Ļ░Éļ│äņØ┤ ņ¢┤ļĀĄļŗż.
ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņØĆ ņ×ÉļØ╝ļ®┤ņä£ ņĀÉņ░© Ēö╝ļČĆļ┐Éļ¦ī ņĢäļŗłļØ╝ Ēö╝ļČĆ ņĢäļלņØś ĻĘ╝ļ¦ē, ĻĘ╝ņ£Ī, Ļ│©Ļ╣īņ¦ĆļÅä ņ╣©ļ▓öĒĢ£ļŗż. ļ¦ÉĻĖ░ņŚÉļŖö ņä▒ņןļźĀņØ┤ Ļ░ĆņåŹĒÖöļÉśĻ│Ā ĻČżņ¢æ, ņČ£Ēśł, ĻĘĖļ”¼Ļ│Ā ĒåĄņ”ØņØä ņØ╝ņ£╝Ēé©ļŗż[4].
ņĄ£ĻĘ╝ņŚÉļŖö ļ│┤ļŗż ņĀĢĒÖĢĒĢ£ ņ¦äļŗ©ņØä ņ£äĒĢ┤ Aiba ļō▒[8]ņØ┤ ĒĢŁ CD34 ĒĢŁņ▓┤ļź╝ ņØ┤ņÜ®ĒĢ£ ļ®┤ņŚŁņĪ░ņ¦üĒÖöĒĢÖņŚ╝ņāēņ£╝ļĪ£ ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆ ņä¼ņ£Ā ņ£ĪņóģņØś ņ¦äļŗ©Ļ│╝ Ļ░Éļ│äņŚÉ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņłśņłĀ ņĀä ņĪ░ņ¦üņāØĻ▓ĆņØ┤ Ļ░Ćņן ĒÖĢņŗżĒĢ£ ņ¦äļŗ©ļ░®ļ▓ĢņØ┤ļ®░ ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ņĀłņĀ£ņāØĻ▓ĆņØä ņŗżņŗ£ĒĢśņśĆļŗż.
Ļ░Éļ│äņ¦äļŗ©ņ£╝ļĪ£ļŖö ņ╝łļĪ£ņØ┤ļō£, Ēö╝ļČĆņä¼ņ£Āņóģ(dermatofibroma), ņ¢æņä▒ ņä¼ņ£Āņä▒ņĪ░ņ¦üĻĄ¼ņóģ(benign fibrous histiocytoma) ļō▒ņØś ņżæĻ░äņŚĮ ņóģņ¢æ(mesenchymal tumor)ņØ┤ ņ׳ņ£╝ļ®░ ļ®┤ņŚŁņĪ░ņ¦üĒÖöĒĢÖĻ▓Ćņé¼Ļ░Ć Ļ░Éļ│äņŚÉ ļÅäņøĆņØ┤ ļÉ£ļŗż. ļ░®ņČöņäĖĒżļŖö ĒŖ╣ņ¦ĢņĀüņ£╝ļĪ£ Ēö╝ļČĆņä¼ņ£ĀņóģņŚÉ ņ¢æņä▒ņØĖ factor XIIIa, ļ®£ļØ╝ļŗī ņäĖĒżņŚÉ ņ¢æņä▒ņØĖ S-100, ĒÅēĒÖ£ĻĘ╝ņóģņ¢æņŚÉ ņ¢æņä▒ņØĖ SMAņŚÉ ņŚ╝ņāēļÉśņ¦Ć ņĢŖļŖö ļ░śļ®┤, CD34ņŚÉ ļīĆĒĢśņŚ¼ņä£ļŖö ņäĖĒżņ¦ł ļé┤ņŚÉ Ļ░ĢĒĢśĻ▓ī ņŚ╝ņāēļÉ£ļŗż. ļ│Ė ņ”ØļĪĆņŚÉņä£ļÅä CD34ņŚÉ ļīĆĒĢśņŚ¼ ņ¢æņä▒ņØĖ ļ░śļ®┤, S-100 ļ░Å SMAņŚÉ ļīĆĒĢśņŚ¼ ņØīņä▒ņØ┤ņŚłļŗż. ļ░śļ®┤ ņ╝łļĪ£ņØ┤ļō£ļŖö ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ļ¦ÄņØĆ ņĮ£ļØ╝Ļ▓É ļŗżļ░£ ļ│ĄĒĢ®ņ▓┤(collagen bundle complexes)ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż[9].
ņ╣śļŻīļŖö Ļ┤æļ▓öņ£ä ņĀłņĀ£Ļ░Ć ņ╣śļŻīņøÉņ╣ÖņØ┤ļ®░ ļ░£ņāØļČĆņ£äņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ 2.5~5.0 cmņØś Ļ▓ĮĻ│äļĪ£ ĻĘ╝ļ¦ēņØä ĒżĒĢ©ĒĢśņŚ¼ ņĢäļלņØś Ēö╝ĒĢśņĪ░ņ¦üņØä ņØ╝Ļ┤ä ņĀ£Ļ▒░ĒĢ£ļŗż[10]. ņĀłņĀ£ ĒøäņŚö ĻĖ░ļŖźņĀüņØ┤Ļ│Ā ļ»ĖņÜ®ņĀüņØĖ ļ®┤ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ×¼Ļ▒┤ņłĀņØä ņŗ£Ē¢ēĒĢśĻ▓ī ļÉśļ®░ Ēö╝ļČĆņØ┤ņŗØņłĀņØ┤ļéś ĻĄŁņåīĒö╝ĒīÉ, ĻĘ╝Ēö╝ĒīÉ, ņ£Āļ”¼Ēö╝ĒīÉ ļō▒ņØś Ēö╝ĒīÉņłĀņØ┤ ņŻ╝ļĪ£ ņō░ņØĖļŗż[11,12]. ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö 3 cmņØś ņĀłņĀ£ņŚ░ņØä ļæÉĻ│Ā ņĀäĻ▓ĮļČĆĻ┤æļ▓öņ£ä ņĀłņĀ£ņłĀņØä ņŗżņŗ£ĒĢśņśĆĻ│Ā ļÅÖĻ▓░ ņĪ░ņ¦ü ņĀłĒÄĖĻ▓Ćņé¼ņŚÉņä£ ņĀłņĀ£ņŚ░Ļ│╝ ĻĖ░ņĀĆļČĆņŚÉņä£ņØś ņóģņ¢æņäĖĒż ņ╣©ņ£żņØ┤ ņŚåņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņłśņłĀ Ēøä Ēö╝ļČĆ Ļ▓░ņåÉļČĆņ£äĻ░Ć ņ╗żņä£ ļīĆĒØēĻĘ╝Ēö╝ĒīÉ(pectoralis major myocutaneous flap)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ▓░ņåÉ ļČĆņ£äļź╝ ņ×¼Ļ▒┤ĒĢśņśĆļŗż.
ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņØś ņ×¼ļ░£ļźĀņØĆ 11~55% ņĀĢļÅäļĪ£ ļŗżņ¢æĒĢśĻ▓ī ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż[12].
ņ×¼ļ░£ņØś ņ¢æņāüņØĆ ņøÉĻ▓® ņĀäņØ┤ļ│┤ļŗżļŖö ĻĄŁņåīņ×¼ļ░£ņØ┤ ĒØöĒĢśļ®░ ĻĄŁņåī ņ×¼ļ░£ļźĀņØĆ ļ│┤Ļ│Āņ×ÉņŚÉ ļö░ļØ╝ 0~60%ļĪ£ Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļéś ļīĆĻ░£ 2.4%ņŚÉņä£ 8.3%ļĪ£ ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ņ£╝ļ®░ ņ×¼ļ░£ĒĢ£ ĒÖśņ×ÉņŚÉņä£ ņĢĮ ļ░śņłśļŖö ņÖĖĻ│╝ņĀü ņĀłņĀ£ņłĀ Ēøä 2ļģä ņØ┤ļé┤ņŚÉ, 80%ļŖö 3ļģä ņØ┤ļé┤ņŚÉ ļ░£ņāØĒĢśņ¦Ćļ¦ī ņŗ£Ļ░äņØ┤ ņ¦Ćļéśņä£ ļ░£ņāØĒĢśļŖö Ļ▓ĮņÜ░ļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż[5].
ĒÖśņ×ÉļŖö ņłśņłĀ Ēøä ņĀüņ¢┤ļÅä ņ▓½ 3ļģä ļÅÖņĢł 3~6Ļ░£ņøöļ¦łļŗż ņČöņĀüĻ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢśĻ│Ā ĻĘĖ Ēøä 1ļģäņŚÉ ĒĢ£ļ▓łņö® ņČöņĀüĻ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢśļŗż[11]. ĻĄŁņåīņ×¼ļ░£ņØĆ ņłśņłĀ Ēøä ļ░®ņé¼ņäĀ ņ╣śļŻīļź╝ ļ│æĒ¢ēĒĢ©ņ£╝ļĪ£ņŹ© ņ£ĀņØśĒĢśĻ▓ī Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░ ĒŖ╣Ē׳ ņĀłņĀ£ņŚ░ņØ┤ ļČłņČ®ļČäĒĢśĻ▒░ļéś ņĀłņĀ£ņŚ░ņØ┤ ņ¢æņä▒ņØ╝ Ļ▓ĮņÜ░ ņ£ĀņÜ®ĒĢśļŗż[13]. ļśÉĒĢ£ ņĀłņĀ£Ļ░Ć ļČłĻ░ĆļŖźĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ļ░®ņé¼ņäĀ ņ╣śļŻīļŖö ņóģņ¢æ Ēü¼ĻĖ░ļź╝ ņżäņØ╝ ņłś ņ׳ļŗż[5]. ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ņĀłņĀ£ņŚ░ņØ┤ ņČ®ļČäĒĢśņśĆņ¦Ćļ¦ī ĻĄŁņåīņ×¼ļ░£ņØ┤ ĒØöĒĢ£ ņóģņ¢æņØ┤ĻĖ░ņŚÉ ĻĄŁņåīņ×¼ļ░£ņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢ┤ ņłśņłĀ Ēøä ļ░®ņé¼ņäĀ ņ╣śļŻīļź╝ ļ│æĒ¢ēĒĢśņśĆļŗż. ņĀäņØ┤ļŖö ļīĆļČĆļČä Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņ£╝ļéś Bowne ļō▒[14]ņØĆ 1%ņØś ņĀäņØ┤ņ£©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņĀäņØ┤ņä▒ ņóģņ¢æņŚÉņä£ ĒĢŁņĢöņ╣śļŻīņØś ĒÜ©Ļ│╝ļŖö ļČäļ¬ģĒĢśņ¦Ć ņĢŖņ£╝ļéś ĒāĆņØ┤ļĪ£ņŗĀ ĒéżļéśņĢäņĀ£ ņ¢ĄņĀ£ņĀ£ņØĖ ĻĖĆļ”¼ļ▓Ī(Glivec, imatinib)ņØ┤ ņĀłņĀ£ ļČłĻ░ĆļŖźĒĢ£ ņ×¼ļ░£ņä▒ ļśÉļŖö ņĀäņØ┤ņä▒ ņóģņ¢æņŚÉņä£ ņóģņ¢æņØś Ēü¼ĻĖ░ļź╝ Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[15].
ļ│Ė ņ”ØļĪĆļŖö ņĀäĻ▓ĮļČĆņŚÉ ļ░£ņāØĒĢ£ ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģņØä ņ╝łļĪ£ņØ┤ļō£ļĪ£ ņśżņØĖĒĢ┤ ļŗ©ņł£ņĀłņĀ£ļ¦īņ£╝ļĪ£ ņ╣śļŻīĒĢśļĀżļŗż ņ£Īņóģņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░ļĪ£, Ē¢źĒøä ļŗ©ņł£ ņ╝łļĪ£ņØ┤ļō£ ņ¢æņāüņØś ņóģļ¼╝ļÅä ņŻ╝ņ£äņĪ░ņ¦üņ£╝ļĪ£ ņ╣©ņ£żņØ┤ ņØśņŗ¼ļÉĀ Ļ▓ĮņÜ░ ņ£ĄĻĖ░ņä▒ Ēö╝ļČĆņä¼ņ£Āņ£ĪņóģļÅä Ļ│ĀļĀżĒĢ┤ ļ│┤ņĢäņĢ╝ ĒĢśļ®░ ņ£Āņé¼ĒĢ£ ņ”ØļĪĆņØś ņ¦äļŗ© ļ░Å ņ╣śļŻī ļ░®ļ▓ĢņØä Ļ▓░ņĀĢĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉśĻ│Āņ×É ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.